
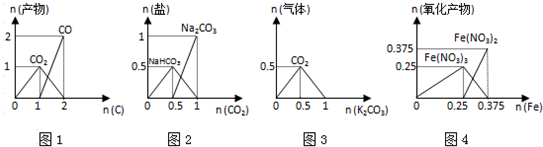
 CO2、CO2+C
CO2、CO2+C  2CO;
2CO; CO2,n(O2)=1mol,生成二氧化碳为1mol,然后发生CO2+C
CO2,n(O2)=1mol,生成二氧化碳为1mol,然后发生CO2+C 2CO,则生成2molCO,图象与反应相符合,故A正确;
2CO,则生成2molCO,图象与反应相符合,故A正确;

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某课外活动小组欲利用下列装置(部分固定装置略)完成下列实验;
某课外活动小组欲利用下列装置(部分固定装置略)完成下列实验;| 步骤 | 实验过程 | 实验现象 | 有关化学方程式 |
| 1 | / | / | |
| 2 | 在C中加入样品W克,D中装入碱石 灰后并称量为m1克.连接好仪器,打开A的活塞,慢慢加溶液. | ||
| 3 | 对C进行加热.当C中药品充分反应后.关闭A的活塞.停止加热: | ||
| 4 | 冷却后,称量D的质量为m2克. | / | / |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
 4Ag+O2↑+4H+
4Ag+O2↑+4H+查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com