
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1820 | 2750 | 11600 |
| A. | 元素X的常见化合价是+3 | |
| B. | 元素Y是ⅢA族元素 | |
| C. | 元素X与氯元素形成化合物时,化学式可能是XCl2 | |
| D. | 若元素Y处于第三周期,它可与冷水剧烈反应 |
分析 X、Y是主族元素,I为电离能,X第一电离能和第二电离能差距较大,说明X为第IA族元素;
Y第三电离能和第四电离能差距较大,说明Y为第IIIA族元素,X的第一电离能小于Y,说明X的金属活泼性大于Y,结合物质性质分析解答.
解答 解:A.X为第IA族元素,元素最高化合价与其族序数相等,所以X常见化合价为+1价,故A错误;
B.通过以上分析知,Y为第IIIA族元素,故B正确;
C.元素X与氯形成化合物时,X的电负性小于Cl元素,所以在二者形成的化合物中X显+1价、Cl元素显-1价,则化学式可能是XCl,故C错误;
D.若元素Y处于第3周期,为Al元素,它不能与冷水剧烈反应,但能溶于酸和强碱溶液,故D错误.
故选B.
点评 本题考查元素电离能和原子结构关系,为高考常见题型,侧重于学生的分析能力的考查,正确推断元素在周期表中的位置是解本题关键,灵活运用基本概念、基本理论结合物质结构、性质解答,题目难度不大.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:解答题
| 物质 | 相对分子质量 | 性质 |
| 废饮料瓶碎片 | 聚对苯二甲酸乙二醇酯:乳白色或浅黄色的聚合物. | |
| 乙二醇(EG) | 62 | 无色无臭液体,对动物有毒性.沸点:196~198℃,与水混溶. |
对苯二甲酸(TPA) | 166 | 白色晶体或粉末,低毒.弱酸.300℃以上升华.不溶于水、乙醚、氯仿等大多数有机溶剂,可溶于DMF等强极性有机溶剂. |
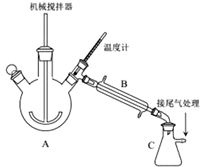
 .
. ,生产时,若消耗EG的物质的量比TPA多4‰,则上述聚合物的链节数n为250.
,生产时,若消耗EG的物质的量比TPA多4‰,则上述聚合物的链节数n为250.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
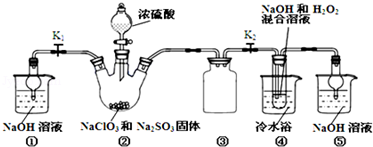
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 主族元素的电负性越大,元素原子的第一电离能一定越大 | |
| B. | 在元素周期表中,元素电负性从左到右越来越小 | |
| C. | 在形成化合物时,电负性越小的元素越容易显正价 | |
| D. | 金属元素的电负性一定小于非金属元素的电负性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
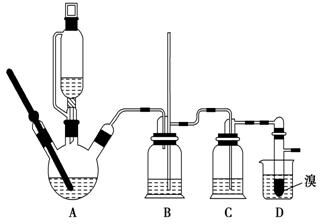 实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2+H2O CH2═CH2+Br2→BrCH2CH2Br
实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2+H2O CH2═CH2+Br2→BrCH2CH2Br| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同族元素,随着核外电子层数的增加,I1逐渐增大 | |
| B. | 通常情况下,对于同一种元素的原子,其电离能I1<I2<I3 | |
| C. | 同周期元素,总体变化趋势是随着核电荷数的增加,I1增大 | |
| D. | 通常情况下,电离能越小,元素的金属性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
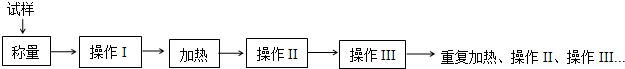
| 加热前质量 | 加热后质量 | ||
| m1 | m2 | m3 | m4 |
| 5.400g | 7.900g | 6.900g | 6.901g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量样品→加热→冷却→称量CuO | |
| B. | 称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量 | |
| C. | 称量样品→加热→冷却→称量Cu(NO3)2 | |
| D. | 称量样品→加NaOH→过滤→加热→冷却→称量CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,正向反应速率减小,逆向反应速率增大 | |
| B. | 升高温度有利于正、逆反应速率增大,从而缩短达到平衡的时间 | |
| C. | 达到平衡后,升高温度或增大压强都有利于该反应平衡逆向移动 | |
| D. | 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com