
����Ŀ���Դ�����Ⱦ��NOx�����о�������Ҫ�������塣
��1����֪��������������NO�ķ�ӦΪ��N2(g)��O2(g)![]() 2NO(g)��Q����1.0 mol������0.80 mol N2��0.20 mol O2��1300oCʱ��10.0 L�ܱ������ھ���5s��Ӧ�ﵽƽ�⣬���NOΪ0.02mol/L����ش��������⣺5s�ڸ÷�Ӧ��ƽ�����ʦ�(N2)��_____________�� ���������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��ԭ���ǣ�______________________________��
2NO(g)��Q����1.0 mol������0.80 mol N2��0.20 mol O2��1300oCʱ��10.0 L�ܱ������ھ���5s��Ӧ�ﵽƽ�⣬���NOΪ0.02mol/L����ش��������⣺5s�ڸ÷�Ӧ��ƽ�����ʦ�(N2)��_____________�� ���������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��ԭ���ǣ�______________________________��
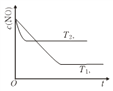
��2����ͼ��ʾ��������������ʱ����Ӧ2NO(g)��2CO(g)![]() 2CO2(g)��N2(g) �У�NO��Ũ��c(NO)�ڲ�ͬ�¶�(T)����ʱ��(t)�ı仯���ߡ���ƽ�������ӦΪ_________��Ӧ (����ȡ����ȡ�)��
2CO2(g)��N2(g) �У�NO��Ũ��c(NO)�ڲ�ͬ�¶�(T)����ʱ��(t)�ı仯���ߡ���ƽ�������ӦΪ_________��Ӧ (����ȡ����ȡ�)��
��3��Ϊ�˼�������β���Ի�������Ⱦ���ɲ�ȡ�Ĵ�ʩ________________________����дһ������
��һ���棬�����������Ϊ���������������������
��4����ˮ��һ�ֺܺõĵ��ʣ������²ⶨ0.1mol/L��ˮ��Һ����pHֵС��13����ԭ����_____���õ��뷽��ʽ���ͣ�����������������______________���о���������
��5�������������ˮ����ˮ��Һ�� ________������ԡ��������ԡ��������ԡ�����ԭ����____________ (�����ӷ���ʽ��ʾ)��
���𰸡� 2.0��10-3mol/(L��s) ����Ӧ��һ�����ȷ�Ӧ���¶����߷�Ӧ��������ͬʱƽ�������ƶ���ʹ��λʱ����NO���ŷ������� ���ȷ�Ӧ �Ľ�������ȼ�շ�ʽ���Ա���������ȫȼ�գ���ʹ�ô�������װ�ã�ʹ�к�����ת���������壻��ʹ����Ǧ���ͣ���ֹ��Ǧ�������ŷţ�����ɫ���� NH3��H2O![]() NH4++OH- �̬���ʡ���̬���ʡ��л����� ���� NH4++H2O
NH4++OH- �̬���ʡ���̬���ʡ��л����� ���� NH4++H2O![]() NH3��H2O+H+
NH3��H2O+H+
����������1��1300oCʱ��10.0 L�ܱ������ھ���5s��Ӧ�ﵽƽ�⣬���NOΪ0.02mol/L, �����ı仯Ũ��Ϊ0.02/2=0.01 mol/L,5s�ڸ÷�Ӧ��ƽ�����ʦ�(N2)��0.01/5=2.0��10-3mol/(L��s) �����ڸ÷�Ӧ����Ӧ��һ�����ȷ�Ӧ���¶����߷�Ӧ��������ͬʱƽ�������ƶ���ʹ��λʱ����NO���ŷ����������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ����ȷ�𰸣�2.0��10-3mol/(L��s) ������Ӧ��һ�����ȷ�Ӧ���¶����߷�Ӧ��������ͬʱƽ�������ƶ���ʹ��λʱ����NO���ŷ������� ��
��2������ͼ���ȹ���ƽ�����ߡ��Ĺ��ɿ�֪���¶�T2����T1���¶���T1��T2��һ��������Ũ������ƽ�����ƣ��÷�Ӧ����ӦΪ���ȷ�Ӧ����ȷ�𰸣����ȷ�Ӧ��
��3��Ϊ�˼�������β���Ի�������Ⱦ���ɲ�ȡ�Ĵ�ʩ�У��Ľ�������ȼ�շ�ʽ���Ա���������ȫȼ�գ���ʹ�ô�������װ�ã�ʹ�к�����ת���������壻��ʹ����Ǧ���ͣ���ֹ��Ǧ�������ŷţ�����ɫ���У���ȷ�𰸣��Ľ�������ȼ�շ�ʽ���Ա���������ȫȼ�գ���ʹ�ô�������װ�ã�ʹ�к�����ת���������壻��ʹ����Ǧ���ͣ���ֹ��Ǧ�������ŷţ�����ɫ���С�
��4��һˮ�ϰ�Ϊ������ʣ���ˮ�в��ַ������룺NH3��H2O![]() NH4++OH- �������Һ��c(OH-)С��0.1mol/L����pHֵС��13�����������������̬���ʡ���̬���ʡ��л����ʣ���ȷ�𰸣�NH3��H2O
NH4++OH- �������Һ��c(OH-)С��0.1mol/L����pHֵС��13�����������������̬���ʡ���̬���ʡ��л����ʣ���ȷ�𰸣�NH3��H2O![]() NH4++OH- ���̬���ʡ���̬���ʡ��л����ʡ�
NH4++OH- ���̬���ʡ���̬���ʡ��л����ʡ�
5�������Ϊǿ�������Σ�ˮ�������ԣ�笠�����ˮ������һˮ�ϰ��������ӣ����ӷ���ʽ ΪNH4++H2O![]() NH3��H2O+H+����ȷ�𰸣����ԣ�NH4++H2O
NH3��H2O+H+����ȷ�𰸣����ԣ�NH4++H2O![]() NH3��H2O+H+��
NH3��H2O+H+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��B��C��D��E��Fԭ��������������������Ԫ�أ�����λ��Ԫ�����ڱ���ǰ�����ڡ�BԪ�غ���3���ܼ����������ܼ������ĵ����������D��ԭ��������8���˶�״̬��ͬ�ĵ�����EԪ����FԪ������ͬһ�������ڵ��壬���ǵ�ԭ����������3����EԪ�صĻ�̬ԭ����4��δ�ɶԵ�������ش��������⣺
��1����д����D��̬ԭ�ӵļ۲��������ͼ__________��F��̬ԭ������Χ��������ʽ��_________��
��2������˵���������_________��
A.������������Է��������ȶ�����̼�����Էе㣺SiO2>CO2
B.�縺��˳����B<C<D
C.N2��COΪ�ȵ����壬�ṹ������
D.�ȶ��ԣ�H2O>H2S��ˮ�������ȶ���ԭ����ˮ���Ӽ�������
��3��F�����������ڶ���ø�ĸ����ӣ��˹�ģ��ø����ǰ�о����ȵ�����F��������Һ��ͨ�������C��A�γɵ�����X������[F (X)4]2+�������ӵĽṹʽΪ______����Ԫ�ط��ű�ʾ����
��4��ij��������F(I)��I��ʾ���ϼ�Ϊ+1������γ�ͼ1��ʾ����������������̼ԭ�ӵ��ӻ���ʽ��________��
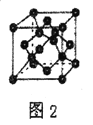
��5��B���ʵ�һ��ͬ���������������ͼ2��ʾ����һ������������Bԭ����Ϊ_______��
��6��D��F�γ�����������Ϊ1��1�Ļ����������NaCl���ƣ���D���ӵİ뾶Ϊa pm, F���ӵİ뾶b pm����þ����Ŀռ�������________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��A��ʯ���ѽ�������Ҫ����֮һ��������Ǻ���һ������ʯ�ͻ�����չˮƽ�ı�־���������л���A��G֮���ת����ϵ��
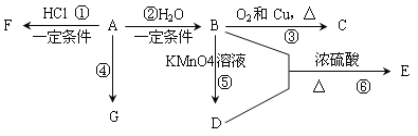
��ش��������⣺
��1��A��D�����������ŵ����Ʒֱ���_______________��C�Ľṹ��ʽ��_____________��
��2��E��һ�־�����ζ��Һ�壬��B + D��E�ķ�Ӧ����ʽΪ��______________����Ӧ������________��
��3��G��һ�ָ߷��ӻ������ṹ��ʽ��____________________________________��
��4������˹�������籭��ս�������ڱ����е��˶�Ա����Ť��ʱ����ҽ�����������˲�λ��������F����Ӧ��������д����A��F�Ļ�ѧ��Ӧ����ʽ��___________��
��5��H��E��ͬ���칹�壬��H����NaHCO3��Ӧ����H�Ľṹ��ʽ����Ϊ(д��2��)��_____________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ҵ���˵����ȷ����
A. �Ҵ����ڿ�����ȼ�� B. �Ҵ������ڵ�����
C. ��ҵ�Ҵ��������������þ� D. �Ҵ���ʳ����Ҫ�ɷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ij�¶�ʱ����һ��10L�ĺ��������У�X��Y��Z��Ϊ���壬�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ��������գ�
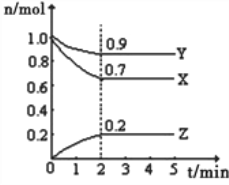
��1����Ӧ��ʼ��2min��������Z��ʾ��ƽ����Ӧ����Ϊ______________________��
��2��ƽ��ʱ�����ڻ�������ܶȱ���ʼʱ__________����������С������ȡ���ͬ������������ƽ����Է�����������ʼʱ___________��
��3����a mol X��b mol Y�Ļ�����巢��������Ӧ����Ӧ��ijʱ�̸����ʵ���ǡ�����㣺n��X��=n��Y��=2n��Z������ԭ���������a��b=___________��
���ں��º��ݵ��ܱ������У����������������ٷ����仯ʱ���ٻ�������ѹǿ���ڻ��������ܶȣ��ۻ������������ʵ������ܻ�������ƽ����Է����������ݻ���������ɫ������Ӧ���������ķ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȡ�
��1��һ����֤��2SO2(g)��O2(g)![]() 2SO3(g)�ﵽƽ��״̬����_______������ţ���ͬ����
2SO3(g)�ﵽƽ��״̬����_______������ţ���ͬ����
��2��һ����֤��I2(g)��H2(g)![]() 2HI(g)�ﵽƽ��״̬���� _________��
2HI(g)�ﵽƽ��״̬���� _________��
��3��һ����֤��A(s)��2B(g)![]() C(g)��D(g)�ﵽƽ��״̬����________����ע��B,C,D��Ϊ��ɫ���ʣ�
C(g)��D(g)�ﵽƽ��״̬����________����ע��B,C,D��Ϊ��ɫ���ʣ�
��.��1��Ǧ�����dz����Ļ�ѧ��Դ֮һ�����硢�ŵ���ܷ�Ӧ�ǣ�2PbSO4 + 2H2O![]() Pb + PbO2 + 2H2SO4, Ǧ���طŵ�ʱ��_______�����������ƣ����������ŵ����������Ũ����5mol/L �½��� 4mol/L�����Һ���Ϊ 2L����Ӧ������Һ����仯���Բ��ƣ�����ŵ���������·��ת�Ƶ��ӵ����ʵ���Ϊ___________mol��
Pb + PbO2 + 2H2SO4, Ǧ���طŵ�ʱ��_______�����������ƣ����������ŵ����������Ũ����5mol/L �½��� 4mol/L�����Һ���Ϊ 2L����Ӧ������Һ����仯���Բ��ƣ�����ŵ���������·��ת�Ƶ��ӵ����ʵ���Ϊ___________mol��
��2��������ƽ����� Pt ˿���缫���� KOH ��Һ�У�Ȼ���������Ϸֱ�ͨ���Ҵ��������� ����ȼ�ϵ�ء����ȼ�ϵ�ع���ʱ����缫��ӦʽΪ��
������_____________
������_____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���������������ء�����������ȷ����
A. ���ڼ��������µ�ˮ�ⷴӦ��������Ӧ![]()
B. ���ϳ����ϡ��ϳ���ά�����˹��ϳɵĸ߷��Ӳ���
C. �Ŵ��Ĵ����С��ڻ�ҩ���ijɷ��ǡ�һ�������ľ̿��������ġ�����ָ��������
D. ���칤������أ������������ߣ���ض����࣬��ȡ��ɳճ����Ϊ֮�������ߡ�����ͳ���ǽ������ϣ���Ҫ�ɷ�Ϊ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���3molA��3molB�������Ϊ 1L���ܱ������У��������·�Ӧ��aA��g��+2B��g��3C��g��+D��g������Ӧ�ﵽƽ���C��Ũ��Ϊ 3mol/L��ѹ�����������ʹ�����������Сһ�룬�����µ�ƽ��ʱ��B��Ũ��Ϊ2mol/L����ʽ��a����ֵΪ��������
A.1
B.2
C.3
D.4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A�������������ϵ���Ҫ���壬��ҵ�ϲ�������B�ֽ��Ʊ�����A��ͬʱ�ͷų����������Ʊ�ԭ���ǣ�
B��g��A��g��+H2��g����H=+125kJmol��1
��1���÷�Ӧ��ƽ�ⳣ������ʽΪK= �� �����¶ȵ����ߣ�Kֵ�����������С�����䡱����
��2��ʵ�������г��Ը���ˮ������Ϊ��Ӧ��ϵ��ϡ�ͼ���ϡ�ͼ����μӷ�Ӧ��������B��ƽ��ת������ˮ��������������ϵ��ѹǿ��ϵ��ͼ��
����ͼ�ɵó���
����һ�������������䣬ˮ����������Խ��ƽ��ת����Խ��
���۶���
�ڼ���ϡ�ͼ���Ӱ�췴Ӧ��B��ƽ��ת���ʵ�ԭ���ǣ� ��
��3��ijЩ�����У��ڷ�Ӧ����;����O2���ض��Ĵ��������������B��ƽ��ת���ʣ��Խ�����ԭ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����c(HA)+c(A-)=0.1mol/L ��һ��HA��KA �����Һ����Һ��c(HA)��c(A-)��pH�Ĺ�ϵ����ͼ��ʾ��������������ȷ����
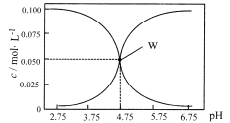
A. pH= 5.75 ����Һ��: c(K+)>c(A- )>c(HA)>q(H+)>c(OH- )
B. ����W ����ʾ��Һ����ʼ������ҺӦ����c(HA)+c(A-)=0.1mol/L ��c(KA)
C. pH=3.75����Һ�У�c(K+)+c(H+)-c(OH-)+c(HA)=0.1mol/L
D. ��A-��ˮ�ⳣ��ΪKb ��lgKb=-9.25
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com