
| A. | 在氧化还原反应中,阴离子只能发生氧化反应 | |
| B. | 碳酸钠溶液显碱性:CO32-+2H2O?H2CO3+2OH- | |
| C. | 有些吸热反应不需要加热也能进行 | |
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
分析 A.阴离子可能被氧化,也可能被还原;
B.碳酸钠为强碱弱酸盐,碳酸根离子水解应分布进行;
C.反应中能量变化与反应条件无关;
D.1mol可燃物燃烧生成稳定氧化物放出的热量是燃烧热.
解答 解:A.阴离子可能被氧化,也可能被还原,如亚硫酸根离子与氯气反应时阴离子被氧化,亚硫酸根离子与硫化氢反应时阴离子被还原,故A错误;
B.碳酸钠为强碱弱酸盐,水解使溶液显碱性,但碳酸根离子水解应分布进行,故B错误;
C.反应中能量变化与反应条件无关,有些吸热反应不需要加热也能进行,如八水合氯化铵和氢氧化钡的反应,故C正确;
D.1mol可燃物燃烧生成稳定氧化物放出的热量是燃烧热,而1mol甲烷燃烧生成气态水不是稳定氧化物,应为液态水和二氧化碳所放出的热量是甲烷的燃烧热,故D错误;
故选C.
点评 本题考查较综合,为高频考点,涉及氧化还原反应、盐类水解、反应中能量变化及燃烧热等,侧重高考高频考点的考查,注意AC利用实例分析,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗分离乙醇与油脂的混合物 | |
| B. | 用玻璃棒蘸取次氯酸溶液点在干燥的pH试纸中部,测定次氯酸溶液的pH | |
| C. | 在含FeCl3杂质的MgCl2溶液中加入适量的MgCO3,微热,充分搅拌,静置,过滤得较纯净的MgCl2溶液 | |
| D. | 将甲烷与氯气按物质的量之比1:2通入烧瓶,光照,制取纯净的CH2Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类和蛋白质都是人体重要的营养物质 | |
| B. | 蛋白质在一定条件下能发生水解反应,生成氨基酸 | |
| C. | 加热能杀死甲型H1N1流感病毒,因为病毒的蛋白质受热变性 | |
| D. | 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,如再加水也不溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑥③②④①⑤ | B. | ⑤④③①②⑥ | C. | ⑥③①②④⑤ | D. | ②③①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、K+、Cl-、S2-四种离子的半径依次减小 | |
| B. | 熔融的NaHSO4中阴阳离子的数目比为1:2 | |
| C. | 氢化锂三兄弟--LiH、LiD、LiT三种物质的质子数之比为4:5:6 | |
| D. | 一个乙醛分子中存在7对共用电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
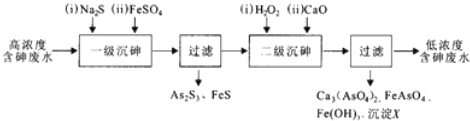
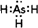
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
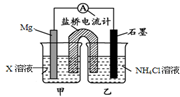
| A. | 盐桥中的K+移向乙烧杯 | |
| B. | 乙烧杯中一直存在:c(Cl-)>c(NH4+) | |
| C. | X可能是CuCl2 | |
| D. | 石墨电极反应式为2NH4++2e-═2NH3↑+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作、现象 | 结 论 | |
| A | 火柴梗上滴少量的浓硫酸;火柴梗变黑 | 浓硫酸具有强氧化性 |
| B | 含锈的铁浸泡在NH4Cl溶液中,铁锈逐渐溶解 | NH4Cl显酸性 |
| C | Ba(NO3)2溶液中通入SO2气体;产生白色沉淀 | BaSO3难溶 |
| D | 某无色溶液中通入过量的CO2气体,有白色沉淀 | 一定含有AlO2- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com