
| A. | 如果存放有钠、电石等危险化学品的仓库着火,消防员不能用水灭火,应用泡沫灭火器灭火 | |
| B. | 用石英制成光导纤维,由水玻璃制硅胶都是化学变化 | |
| C. | 火法炼铜、湿法炼铜都是置换反应 | |
| D. | 糖类、油脂、蛋白质都是高分子化合物 |
分析 A.钠和水、氧气反应,钠燃烧生成过氧化钠,过氧化钠和二氧化碳、水反应生成氧气,电石与水反应生成可燃性气体乙炔;
B.化学变化存在新物质生成,物理变化不存在新物质生成;
C.火法炼铜的原理是硫化亚铜与氧气在高温下反应生成铜和二氧化硫,该反应的化学反应方程式为:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2;湿法炼铜就是用金属铁与铜的盐溶液反应,方程式:Fe+CuSO4=FeSO4+Cu;
D.对分子质量在10000以上的有机化合物为高分子化合物;
解答 解:A.钠和水反应生成氢气,氢气是易燃物,钠燃料后生成过氧化钠,过氧化钠和水、二氧化碳反应生成氧气,促进钠的燃烧,电石与水反应生成可燃性气体乙炔,所以钠、电石等着火燃烧时,不能用泡沫灭火器灭火,应该用沙子灭火,故A错误;
B.用石英制成光导纤维,没有新物质生成属于物理变化,由水玻璃制硅胶存在新物质生成,是化学变化,故B错误;
C.火法炼铜:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2;湿法炼铜:Fe+CuSO4=FeSO4+Cu,二者都是一种单质与一种化合物反应生成另一种单质和另一种化合物,属于置换反应,故C正确;
D.糖类中的单糖、二糖和油脂相对分子质量较小,不属于高分子化合物,故D错误;
故选:C.
点评 本题考查了物质的性质和用途,涉及灭火方法选择,物理变化、化学变化的判断,火法炼铜、湿法炼铜原理,高分子化合物概念,题目难度不大,熟悉相关物质的性质和相关概念是解题关键.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题

| A. | 咖啡酸分子中所有原子可能处在同一个平面上 | |
| B. | 通常条件下,咖啡酸和苯乙醇都能发生取代、加成、消去、氧化反应 | |
| C. | 1molCPAE与H2反应,最多可消耗8molH2 | |
| D. | 可用FeCl3溶液检测上述反应是否有CPAE生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
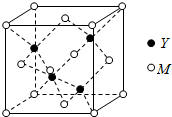 M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子.元素Y的负一价离子的最外层电子数与次外层的相同.回答下列问题:
M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子.元素Y的负一价离子的最外层电子数与次外层的相同.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
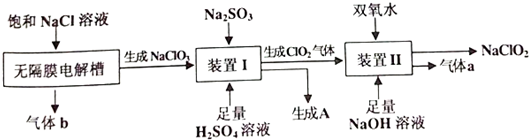


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
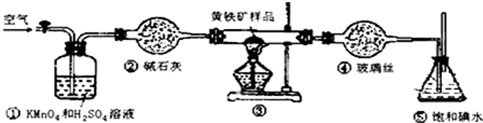
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.98 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
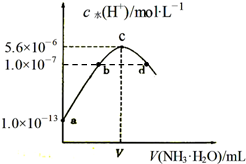 常温下,向20mL某浓度的硫酸溶液中滴入0.1mol•L-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )
常温下,向20mL某浓度的硫酸溶液中滴入0.1mol•L-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )| A. | 由图可知稀硫酸的浓度为0.1 mol•L-1 | |
| B. | b点溶液pH=7 | |
| C. | c点所示溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | d点所示溶液中:c(NH4+)=2c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
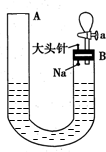 如图是有关钠与水反应及产物检验的实验装置.实验开始时先向管内加入滴有酚酞的水,使水位达到B端管口,然后迅速塞紧橡胶塞并拔掉大头针,此时Na掉入水中.回答下列问题:
如图是有关钠与水反应及产物检验的实验装置.实验开始时先向管内加入滴有酚酞的水,使水位达到B端管口,然后迅速塞紧橡胶塞并拔掉大头针,此时Na掉入水中.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com