
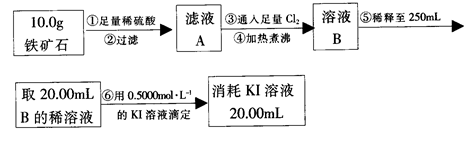
(16分)铁触媒(铁的某氧化物)是工业合成氨的催化剂。某同学设计了以下两种方案研究铁触媒的组成。
方案一:用下列流程测定铁触媒的含铁量,确定其组成。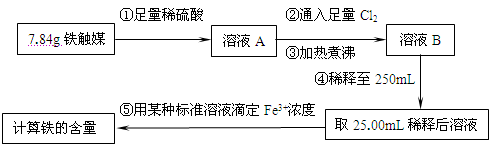
(1)步骤④后面需用 (填仪器名称)取25.00mL稀释后溶液。
(2)因为通入Cl2不足量,“溶液B”中还含有 会影响测定结果。
(3)因为通入Cl2过量且加热煮沸不充分,“溶液B”中可能含有Cl2。请设计实验方案检验Cl2,完成下列实验报告。
限选试剂:0.1mol·L-1酸性KMnO4溶液、紫色石蕊试液、品红稀溶液、淀粉-KI溶液、0.1moL·L-1KSCN溶液
| 实验操作 | 实验现象与结论 |
| | |
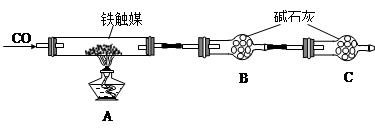
(1)酸式滴定管(或移液管)(2分)(2)FeCl2或者FeSO4或者Fe2+(2分)
(3)实验操作 预期现象和结论 取适量溶液B于试管中,滴加2-3滴紫色石蕊试液,振荡,观察现象。(2分) 若溶液显红色,后红色褪去,则溶液B中含Cl2(2分);
若溶液变红后不褪色,则溶液B不含有Cl2(2分)
(加入品红稀溶液也得分)
(4)防止空气中的CO2和水蒸气进入B中(2分)(5)Fe4O5或2FeO·Fe2O3(4分)
解析试题分析:(1)要量取25.00mL稀释后溶液,则需要滴定管(或移液管)。由于溶液显酸性,因此应该用酸式滴定管。
(2)氯气具有强氧化性,如果氯气不足,则溶液中就可能含有未被氧化的亚铁离子。
(3)氯气具有氧化性,能氧化碘化钾。但由于溶液中含有铁离子,铁离子也能氧化碘化钾,所以不能选择淀粉碘化钾。由于氯气溶液中显酸性,同时生成你的次氯酸还具有强氧化性,具有漂白性,据此可以检验。即取适量溶液B于试管中,滴加2-3滴紫色石蕊试液,振荡,观察现象。若溶液显红色,后红色褪去,则溶液B中含Cl2;若溶液变红后不褪色,则溶液B不含有Cl2。
(4)CO还原铁的氧化物生成单质铁和CO2,CO2被碱石灰吸收,据此可以计算铁的氧化物中氧元素的质量。但由于空气中含有CO2和水蒸气,也能被碱石灰吸收干扰实验,所以C中碱石灰的作用是防止空气中的CO2和水蒸气进入B中。
(5)碱石灰吸收反应中生成的CO2,所以碱石灰增加的质量就是CO2的质量。则根据“干燥管B”增重11.0g可知,反应中生成CO2的物质的量=11.0g÷44g/mol=0.25mol。CO结合氧化物中氧元素生成CO2,所以氧化物中氧元素的质量=0.25mol×16g/mol=4.0g,则氧化物中铁元素的质量=15.2g-4.0g=11.2g,物质的量=11.2g÷56g/mol=0.2mol,因此氧化物中铁和氧的原子个数之比=0.2:0.25=4:5,所以该铁触媒的化学式可表示为Fe4O5或2FeO·Fe2O3。
考点:考查滴定实验仪器的选择、氯气的性质以及检验、实验方案设计与评价以及铁氧化物化学式的确定


科目:高中化学 来源: 题型:实验题
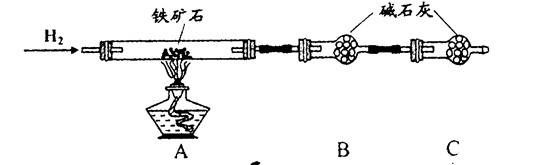
氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有趾Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:AlN+NaOH+H2O=NaAlO2+NH3↑)
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。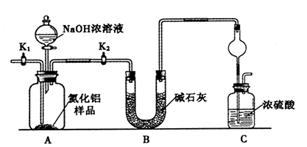
(1)上图C装置中球形干燥管的作用是______________。
(2)完成以下实验步骤:组装好实验装置,首先____________,再加入实验药品。接下来的实验操作是______________,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见___________。
【方案2】用右图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。
(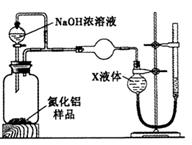
(4)为测定生成气体的体积,量气装置中的X液体可以是_________________________。
a.CCl4 b.H2O c.NH4Cl溶液 d.
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AIN的质量分数__。
【方案3】按以下步骤测定样品中A1N的纯度:
(6)步骤②生成沉淀的离子方程式为___________________。
(7)若在步骤③中未洗涤,测定结果将__________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置。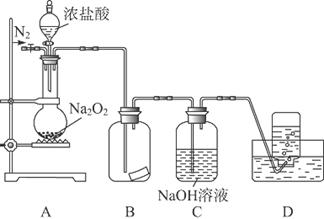
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中的湿润的红色纸条褪色,证明A中反应有________(填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因________________。
(2)装置C的作用是_________________________________________________________。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为①_________________________________________________________________;
②______ __。
(4)实验证明,Na2O2能与干燥的HCl反应,完成并配平该化学方程式。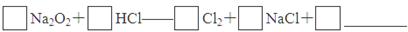
该反应________(填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是___________________________________________________________________________________________________________________________________(要求答出要点)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验: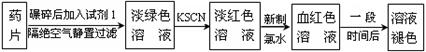
(1)试剂1是 ,加入新制氯水后溶液中发生的离子反应方程式是: , ;
(2)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是 ;
(3)在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
| 编号 | 猜 想 |
| 甲 | 溶液中的+3价Fe又被还原为+2价Fe |
| 乙 | 溶液中的SCN-被过量的氯水氧化 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | | |
| | | |
| | | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白: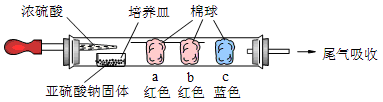
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | | 棉球变白,微热后又恢复红色 |  |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | | 棉球变为白色 | 结论:该气体具有 性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为测定Na2CO3和NaHCO3固体混合物中Na2CO3的质量分数,称取一定质量的样品,甲同学利用图I所示装置测量产生CO2的体积,乙同学利用图II所示装置通过干燥管的增重测量产生CO2的质量,已知所用稀硫酸均足量。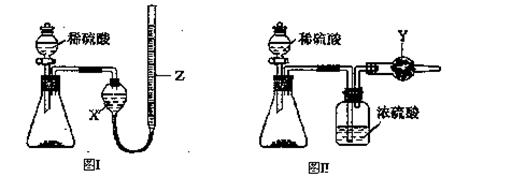
(l)盛放稀硫酸的仪器名称为 。
(2)试剂X为 ;试剂Y为 。
(3)甲同学在进行实验时,为减小误差,应注意的事项有(填选项字母) 。
A.读数前应使整套装置冷却至室温
B.调整Z的高度使量气装置左右液面相平
C.读数时视线与Z内凹液面最低点相切
D.读数前应通入一定量的N2使生成的CO2全部进入量气装置
(4)按乙同学的实验方案进行实验,使测得的Na2CO3的质量分数偏高的因素有(写一种)
,使测得的Na2CO3的质量分数偏低的因素有
(写一种) 。
(5)为完成相同的测定任务,下列实验方案不能达到实验目的的是 (填选项字母)。
A.取mg混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干得ng固体
B.取mg混合物与足量盐酸充分反应,将溶液加热、蒸干、灼烧得ng固体
C.取mg混合物充分加热,固体质量减少ng
D.将图II装置中的稀硫酸改为稀盐酸进行实验
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂(每片b克)中铁元素的含量。实验步骤如下: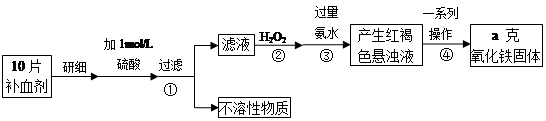
请回答下列问题:
(1)步骤②中H2O2的作用是使Fe2+完全被 (填“氧化”或“还原”)为 Fe3+.
(2)步骤③所得的红褐色悬浊液中除H2O2、氨水外主要还含 和 (填化学式).
(3)步骤④中一系列处理的操作步骤为 、洗涤、灼烧、冷却、称量.
(4)实验中用已经准确量取的浓硫酸配制100 mL 1 mol/L的硫酸溶液,则配制时用到的仪器除烧杯、玻璃棒,还有两种仪器是 .
(5)若实验无损耗,则每片补血剂含铁元素的质量分数为 .
(6)下列操作会导致所测定的铁元素含量偏高的是
A. 步骤③所加氨水量不足 B. 步骤④洗涤不充分 C. 步骤④灼烧不充分
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氯化亚铁溶液中滴加硫氰化钾溶液,再滴加双氧水,立即出现血红色,后红色又褪去呈黄色并伴有气泡产生,针对该实验现象,某实验小组的同学进行了探究
一、现象分析
假设A:气泡是H2O2分解产生的O2
假设B:气泡是KSCN被氧化为N2、SO2、CO2等
假设C:红色褪去的原因是KSCN被氧化成了其它物质
二、实验探究
探究1
| 实验操作 | 实验现象 | 结论 |
| ①1mL 0.1mol/L的FeCl2溶液中加2滴KSCN溶液 | 溶液不变红 | Fe2+遇SCN-不变红 |
| ②向①的溶液中加3%的H2O21滴并振荡 | 立即出现血红色 振荡后不褪色 | 加入H2O2后溶液中 出现了 (离子符号) |
| ③向②的溶液中继续加H2O2溶液 | 溶液中出现大量气泡 血红色褪去 | |
| ④用带火星的木条检验③中的气体 | 木条复燃 | 则假设 成立 |
| 实验操作 | 实验现象 | 结论 |
| ①取2ml KSCN溶液向其中加入几滴BaCl2溶液和稀盐酸 | 无明显现象 | |
| ②向①所得的溶液中滴加3%的H2O2 | 溶液中出现白色沉淀并有少量气泡 | 白色沉淀为BaSO4 |
| ③将6%的H2O2溶液加入KSCN固体中,生成的气体依次通过品红溶液,酸性KMnO4溶液和澄清的石灰水 | | KSCN被H2O2氧化生成了SO2和CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
| A.氯水的颜色呈浅绿色,说明氯水中含有Cl2 |
| B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
| C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
| D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com