
【题目】A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
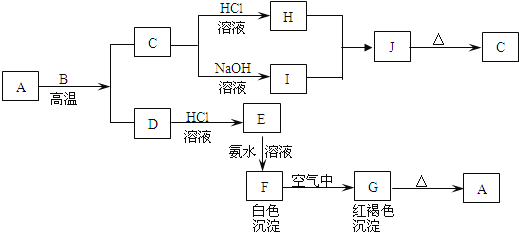
(1)写出下列物质的化学式:A:________,E:________,J:________,G:________.
(2)按要求写方程式:
①A与B在高温条件下生成C和D的化学方程式:________________________________;
②C转化为I的离子方程式:___________________________________________.
③F在空气中转化为G的化学方程式:__________________________________;
【答案】 Fe2O3 FeCl2 Al(OH)3 Fe(OH)3 Fe2O3+2Al![]() Al2O3+2Fe Al2O3+2OH-===2AlO+H2O 4Fe(OH)2+O2+2H2O===4Fe(OH)3
Al2O3+2Fe Al2O3+2OH-===2AlO+H2O 4Fe(OH)2+O2+2H2O===4Fe(OH)3
【解析】A是一种红棕色金属氧化物,所以是三氧化二铁,和金属B在高温下发生铝热反应,生成的C为铝的氧化物,既能和酸反应又能和碱反应,白色沉淀在空气中变成红褐色沉淀,一定是氢氧化亚铁和氢氧化铁之间的转换,所以G是氢氧化铁,F是氢氧化亚铁,根据物质的性质可推断得,E是氯化亚铁,D是金属铁,J是一种难溶于水的白色化合物为氢氧化铝,则金属B是铝,H是氯化铝,I是偏铝酸钠,
(1)根据上面的分析可以知道,则A为![]() ,E是氯化亚铁,J是氢氧化铝,G是氢氧化铁,
,E是氯化亚铁,J是氢氧化铝,G是氢氧化铁,
因此,本题正确答案是:![]() ;
;![]() ;
;![]() ;
;![]() ;
;
(2)![]() 与Al在高温条件下生成Fe和
与Al在高温条件下生成Fe和![]() ,化学方程式为
,化学方程式为![]()
氧化铝是两性氧化物,能和烧碱反应生成偏铝酸钠和水,离子反应方程式为![]() 因此,本题正确答案是:
因此,本题正确答案是: ![]()
;![]()
③由G是氢氧化铁,F是氢氧化亚铁,F在空气中转化为G的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是
A. 2.4g金属镁所含电子数目为0.2NA
B. 16g CH4所含原子数目为NA
C. 17gNH3所含质子数目为17 NA
D. 18g水所含分子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷是地壳中含量较为丰富的非金属元素,它的单质和化合物在工农业生产中应用广泛。白磷可通过反应 2Ca3(PO4)2+10C→6CaO+P4+10CO 获得。完成下列填空:
(1)磷原子的最外层电子排布式是__________,氧原子核外有______种不同运动状态的电子。C、O两种元素非金属性较强的是_______________。
(2)白磷在空气中露置时间长了会因温度达到____而自燃,使白磷升温的热量主要来自_________。某温度时,在2.0L恒容密闭容器中充入0.5mol PCl5,发生反应PCl5(g)![]() PCl3(g)+Cl2(g)-Q,经过一段时间后达到平衡。
PCl3(g)+Cl2(g)-Q,经过一段时间后达到平衡。
(3)该反应的平衡常数表达式 K=_____________;
(4)其他条件不变,起始时向上述容器中充入1.0 mol PCl5,达到平衡时,PCl5的转化率____(选填“增大”、 “减小”“不变”),平衡常数 K____(选填“增大”、 “减小”“不变”)。
(5)在不同时间(t)测得反应过程中 PCl5 的部分数据如下:
t(s) | 0 | 50 | 100 | 250 | 350 |
n(mol) | 0.5 | 0.42 | 0.41 | 0.40 | 0.40 |
则 100s 时, PCl3的物质的量浓度是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向硫酸铜溶液中加入一小块金属钠后,观察到的现象有
①钠浮于液面上 ②熔化成小球 ③发出嘶嘶的响声,放出气体
④钠周围蓝色沉淀部分变黑 ⑤有蓝色沉淀产生 ⑥析出大量红色的铜
⑦小球在溶液中沉浮 ⑧小球在液面上游动、逐渐变小,直至消失
A. ①②③④⑤⑥ B. ①②③④⑤⑧ C. ①②③⑥⑧ D. ②⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳化学”是绿色化学的重要组成部分。
(1)由CO2制备甲醇的过程发生的主要反应如下:
反应I: CO2(g)+ 3H2(g) ![]() CH3OH(g)+ H2O(g) △H 1<0;
CH3OH(g)+ H2O(g) △H 1<0;
向2 L恒容密闭容器中充入3molH2和1.5molCO2,在一定条件下该反应l0min时达到平衡状态,二氧化碳的转化率a(CO2)=60%,则v(H2) =_________________________。(填字母)。
若要同时提高反应速率和甲醇的产量,以下措施一定可行的是
a.升高温度 b.缩小容器体积 c.分离出甲醇 d.增加CO2的浓度
(2)已知: CO2(g)+ 2H2(g)![]() C(s)+ 2H2O(g) △H =-90.0kJ/mol ;H2O(1)=H2O(g) △H =+44.0kJ/mol; C(s)的燃烧热为394.0kJ/mol。则H2的燃烧热为_________kJ/mol。
C(s)+ 2H2O(g) △H =-90.0kJ/mol ;H2O(1)=H2O(g) △H =+44.0kJ/mol; C(s)的燃烧热为394.0kJ/mol。则H2的燃烧热为_________kJ/mol。
(3)在某条件下,将4molH2和1molCO2,置于2L密闭容器中发生反应:
反应II :CO2(g)+4H(g) ![]() CH4(g)+2H2O(g) △H2
CH4(g)+2H2O(g) △H2
反应Ⅲ: CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
CO2转化率、CH4和CO 选择性随温度变化情况分别如图所示(选择性: 转化的CO2中生成CH4或CO 的百分比)。
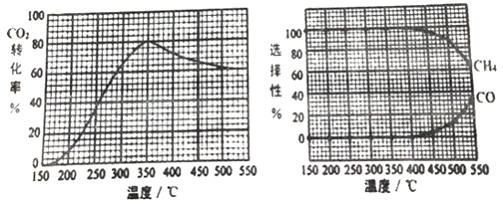
①反应II的△H2________(填“>”、“<“或“=")0,理由是_________________________。
②350℃时,反应II 的平衡常数K=_______。为减少CO 在产物中的比率,可采取______的措施有______(例举一例回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.AlCl3溶液中通入过量的氨水:Al3++4NH3·H2O=AlO2-+2H2O+4NH4+
B.向NH4 HCO3溶液中加过量NaOH 溶液并加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
C.将Cu片加入稀硝酸中:3Cu+8H++2NO3- =3Cu2++2NO↑+4H2O
D.向Na2S2O3溶液中加入稀硫酸:2S2O32—+2H+=SO42—+3S↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)粗制CuSO45H2O晶体中常含有杂质Fe2+ . ①在提纯时为了除去Fe2+ , 常加入合适氧化剂,使Fe2+氧化为Fe3+ , 下列物质最好选用的是 .
A.氯水 B.HNO3 C.KMnO4 D.H2O2
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3 , 调整溶液pH可选用下列中的 .
A.CuOB.Cu(OH)2 C.NaOH D.NH3H2O
(2)在25℃下,向浓度均为0.1molL﹣1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为 . 已知25℃时Ksp[Mg(OH)2]=1.8×10﹣11 , Ksp[Cu(OH)2]=2.2×10﹣20 .
(3)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, ![]() = . [Ksp(AgBr)=5.4×10﹣13 , Ksp(AgCl)=2.0×10﹣10].
= . [Ksp(AgBr)=5.4×10﹣13 , Ksp(AgCl)=2.0×10﹣10].
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com