
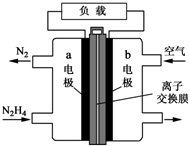
 氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:分析 (1)依据氮原子的原子序数是7,结合原子结构示意图分析判断;
(2)NH3与NaClO反应可得到肼(N2H4),依据氧化还原反应化合价变化分析书写化学方程式;
(3)依据盖斯定律,结合题干热化学方程式计算写出;
(4)①燃料电池的正极是氧气在正极发生还原反应,是负极发生氧化反应,是肼在反应,注意电解质溶液的酸碱性即可;
②原电池中阴离子移向负极;
③据负极电极反应式计算消耗燃料肼的质量.
解答 解:(1)氮元素原子的原子序数为7,第2周期ⅤA族,故答案为:第2周期ⅤA族;
(2)NH3与NaClO反应可得到肼(N2H4),次氯酸钠做氧化剂,依据氧化还原反应的电子守恒和原子守恒写出该反应的化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O;故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(3)①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ?mol-1
②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
根据盖斯定律写出肼和N2O4反应的热化学方程:②×2-①得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol;
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol;
(4)①燃料电池的正极是氧气在正极发生还原反应,负极发生氧化反应,是肼在反应,肼中的N从-2价升高到0价,碱性电池中,其电极反应式应为:N2H4+4OH--4e-=N2+4H2O,
故答案为:空气或氧气;N2H4+4OH--4e-=N2+4H2O;
②原电池中阴离子移向负极,a为负极,所以电池工作时,OH-移向a电极,故答案为:a;
③负极电极反应式为N2H4+4OH--4e-=4H2O+N2↑,转移4mol电子时消耗肼32g,则转移5mol电子消耗肼32g×$\frac{5}{4}$=40g,故答案为:40.
点评 本题考查了原子结构示意图、化学方程式的书写以及热化学方程式的书写和燃料电池电极反应,综合性较强,中等难度.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1000mL水中所含K+、SO42-总数为0.15NA | |
| B. | 500mL溶液中含有0.1NA个K+ | |
| C. | 1L溶液中K+的浓度为0.1mol/L | |
| D. | 1L溶液中SO42-的浓度是0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | XOH物质的量浓度(mol•L-1) | 盐酸物质的量浓度(mol•L-1) | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | b | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
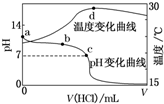 室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点由水电离出的c(H+)=1.0×10-14 mol•L-1 | |
| B. | b点:c(NH${\;}_{4}^{+}$)+c(NH3•H2O)=c(Cl-) | |
| C. | c点:c(Cl-)=c(NH${\;}_{4}^{+}$) | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③⑤ | C. | ①④ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl3饱和溶液中滴加NaOH溶液形成红褐色的分散系 | |
| B. | 一支钢笔使用两种不同牌子的蓝黑墨水,易出现堵塞 | |
| C. | 在河水与海水的交界处,易有三角洲形成 | |
| D. | 水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com