
| A、正逆反应的速率相等 |
| B、正逆反应都还在继续进行 |
| C、正逆反应的速率均为零 |
| D、反应混合物中各组分的浓度相等 |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
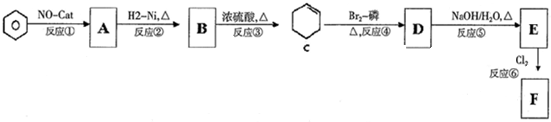
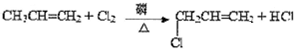 F的结构简式为
F的结构简式为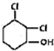
 直接制
直接制 ,理由是
,理由是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Na2SiO3溶液中通入CO2产生白色胶状沉淀 |
| B、NaOH溶液不能存放在磨口玻璃塞的试剂瓶中 |
| C、二氧化硅溶于水生成硅酸 |
| D、二氧化硅是一种熔沸点很高、硬度很大的氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤正确 | B、都不正确 |
| C、③④正确 | D、仅⑤正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠和水反应:2Na2O2+2H2O=4Na++4 OH-+O2↑ | ||||
B、用铜为电极电解饱和食盐水:2Cl-+2H2O
| ||||
| C、在明矾溶液中滴加过量氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O | ||||
| D、小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com