
 研究工业废弃物的处理和防治具有重要的意义.
研究工业废弃物的处理和防治具有重要的意义.分析 (1)根据元素化合价的变化来判断氧化剂的化合价降低;根据反应方程式分析判断;
(2)在催化剂条件下NO和CO反应,生成CO2和N2;
(3)无色废水中不含Fe3+,
I.进行焰色反应实验,火焰为无色,说明无钠离子;
Ⅱ.取100mL废水,加入足量的BaCl2溶液,生成2.33g白色沉淀,说明溶液中含有硫酸根离子,而且物质的量为0.01mol;
Ⅲ.取100mL废水,逐滴加入1.0mol•L-1的NaOH溶液,说明溶液中含有铝离子,而铝离子的物质的量为:$\frac{1×0.03}{3}$mol=0.01mol,由此分析解答.
解答 解:(1)反应CH4+2NO2 $\frac{\underline{\;催化剂\;}}{\;}$N2+CO2+2H2O中甲烷中碳元素的化合价由-4价生成到CO2 中的+4价,失电子,作还原剂,NO2 中氮元素化合价由+4价降低到0价,得电子,作氧化剂,标况下11.2L甲烷的物质的量为0.5mol,消耗NO2 1mol,
故答案为:NO2;1;
(2)将CO和NO转化为参与大气循环的无毒气体,该气体是氮气,该反应的化学方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,
故答案为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
(3)Fe3+呈黄色,某无色废水中一定没有Fe3+,钠的焰色为黄色,进行焰色反应实验,火焰为无色,一定没有Na+,向废水中加入足量的BaCl2溶液,生成2.33g白色沉淀,一定含有SO42-,根据溶液呈电中性,一定有Al3+,铝离子与OH-不能大量共存,一定没有OH-,
①由以上分析可知该废水中一定不含有的离子是Fe3+、Na+、OH-,故答案为:Fe3+、Na+、OH-;
②配制溶液需要的仪器有托盘天平、药匙、烧杯、玻璃棒、100ml容量瓶和胶体滴管,所以除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器有100ml容量瓶.故答案为:100ml容量瓶;
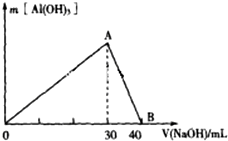
③图中A→B是氢氧化铝沉淀溶解的过程,反应的离子方程式为Al(OH)3+4OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
④根据题意2.33g硫酸钡沉淀的物质的量为0.01mol,则SO42-的物质的量为0.01mol,根据图象Al3++3OH-=Al(OH)3,消耗氢氧化钠30mL,物质的量为0.03mol,则Al3+物质的量为0.01mol,根据溶液呈电中性,一定有Cl-,物质的量为0.01mol,则c(Cl-)=0.01mol÷0.1L=0.1mol/L.
故答案为:含有;0.1mol/L.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析、计算能力的考查,关键是图象分析离子特征和离子共存的判断,题目难度中等.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
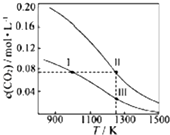 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)的△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)<2P总(状态Ⅰ) | |
| C. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
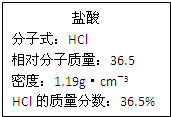 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
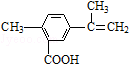
| A. | 在一定条件下,能发生取代、氧化和加聚反应 | |
| B. | 该物质分子中最多可以有11个碳原子在同一平面上 | |
| C. | 1 mol该物质最多可与5 mol H2发生加成反应 | |
| D. | 1 mol该物质完全氧化最多可消耗13 mol氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
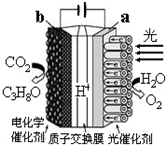 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和C3H8O.下列说法错误的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和C3H8O.下列说法错误的是( )| A. | 该装置将光能和电能转化为化学能 | |
| B. | 该装置工作时,H+从a极区向b极区迁移 | |
| C. | 每还原44 g CO2,理论上可生成33.6L O2 | |
| D. | b电极的反应为:3CO2+18H++18e-═C3H8O+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度和增大压强 | B. | 降低温度和减小压强 | ||
| C. | 降低温度和增大压强 | D. | 升高温度和减小压强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com