
【题目】A、B、C、D均为化学常见的纯净物,A是单质.它们之间有如下的反应关系:

(1)若B是气态氢化物,C、D是氧化物且C是造成酸雨的主要物质。B与C可反应生成A,写出该反应的化学方程式:
(2)若A是太阳能电池用的光伏材料,B为A单质的氧化物,C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出B→C的离子方程式:
(3)若B为淡黄色固体,②③反应均用到同一种液态氢化物,D物质常用于食品工业。
B所含化学键的类型是 。写出B→C的化学方程式: .
(4)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体.写出C→D的离子方程式: .
(5)若A是应用最广泛的金属,④反应用到A,②⑤反应均用到同一种非金属单质。写出C→D的离子方程式: .
【答案】(1)SO2+2H2S=3S↓+2H2O
(2)SiO2+2OH-=SiO32-+H2O
(3)离子键与共价键;2Na2O2+2H2O=4NaOH+O2↑
(4)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-或[Al(OH)4]-+CO2=Al(OH)3↓+HCO3-
(5)2Fe3++Fe=3Fe2+
【解析】
试题分析:(1)C是造成酸雨的主要物质,C是SO2,则A是S、B是H2S、D是SO3;H2S与SO2反应生成S的化学方程式为SO2 + 2H2S = 3S↓+ 2H2O;(2)若A是太阳能电池用的光伏材料,A是Si,B为SiO2,C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性,C、D分别为![]() 、
、![]() 。B→C的离子方程式,SiO2+2OH- = SiO32-+H2O;(3)若B为淡黄色固体,B是过氧化钠,②③反应均用到同一种液态氢化物,液态氢化物为水,过氧化钠与水反应生成氢氧化钠,C是氢氧化钠,D物质常用于食品工业,D是碳酸氢钠。过氧化钠所含化学键的类型是离子键与共价键。B→C的化学方程式2Na2O2+2H2O=4NaOH+O2↑;(4)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体二氧化碳,则A、B、C、D分别是Al、Al2O3、NaAlO2、Al(OH)3; C→D的离子方程式AlO2-+CO2+2H2O = Al(OH)3↓+HCO3- 或 [Al(OH)4] -+CO2= Al(OH)3↓+HCO3-;(5)若A是应用最广泛的金属,A是Fe,④反应用到A,②⑤反应均用到同一种非金属单质, C、D分别是
。B→C的离子方程式,SiO2+2OH- = SiO32-+H2O;(3)若B为淡黄色固体,B是过氧化钠,②③反应均用到同一种液态氢化物,液态氢化物为水,过氧化钠与水反应生成氢氧化钠,C是氢氧化钠,D物质常用于食品工业,D是碳酸氢钠。过氧化钠所含化学键的类型是离子键与共价键。B→C的化学方程式2Na2O2+2H2O=4NaOH+O2↑;(4)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体二氧化碳,则A、B、C、D分别是Al、Al2O3、NaAlO2、Al(OH)3; C→D的离子方程式AlO2-+CO2+2H2O = Al(OH)3↓+HCO3- 或 [Al(OH)4] -+CO2= Al(OH)3↓+HCO3-;(5)若A是应用最广泛的金属,A是Fe,④反应用到A,②⑤反应均用到同一种非金属单质, C、D分别是![]() 、
、![]() 。C→D的离子方程式:2Fe3++Fe=3Fe2+。
。C→D的离子方程式:2Fe3++Fe=3Fe2+。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案科目:高中化学 来源: 题型:
【题目】用下列装置进行相应实验,不能达到实验目的的是

A. 图 1 所示装置可用于制备氢氧化亚铁
B. 图 2 所示装置可用于测定 Na2CO3 和 NaHCO3 混合物中 NaHCO3 的含量
C. 图 3 所示装置可用于检验氨气溶于水后显碱性
D. 图 4 所示装置可用于 CaCO3 和稀盐酸反应制取少量的 CO2 气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分夹持装置已略去)进行实验。 [制取氨气的反应原理: 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O]
CaCl2+2NH3↑+2H2O]
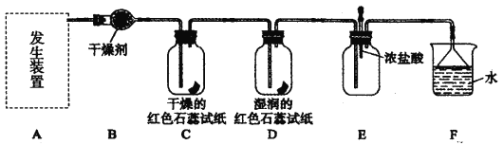
【实验探究】
(1) 利用上述原理,实验室制取氨气应选用下图中_______发生装置进行实验。

(2)B 装置中的干燥剂可选用________( 填“碱石灰”或“浓硫酸”)。
(3)用 5.35 g NH4Cl 固体与足量 Ca(OH)2 反应,最多可制得标准状况下氨气的体积为_________L。( NH4Cl 的摩尔质量为 53.5 g·mol-1)
(4)气体通过 C、D 装置时,试纸颜色会发生变化的是 __________( 填“C”或“D”)。
(5)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2 滴浓盐酸,可观察到的现象是__________。
(6)F装置中倒置漏斗的作用 _____________。
(7)某同学用氨气和滴加酚酞的水做喷泉实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有___________性质(填序号)。
a.还原性 b.极易溶于水 c.与水反应生成碱性物质
(8)氨气的用途很广。如可用氨气处理二氧化氮: 8NH3 + 6NO2 =7N2 + 12H2O该反应中氨气体现________( 填“氧化性”或“还原性”)。请你列举出氨气的另一种用途__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为2:1,以下说法不正确的是( )
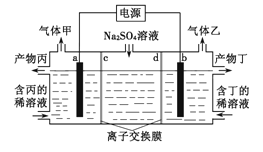
A.a极与电源的负极相连
B.离子交换膜d为阴离子交换膜
C.产物丙为硫酸溶液
D.a电极反应式:2H2O+2e-=H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 向鸡蛋清的溶液中加入浓的硫酸钠溶液或福尔马林,蛋白质的性质发生改变并凝聚
B. 将牛油和烧碱溶液混合加热,充分反应后加入热的饱和食盐水,上层析出甘油
C. 氨基酸为高分子化合物,种类较多,分子中都含有—COOH和—NH2
D. 淀粉、纤维素、麦芽糖在一定条件下可和水作用转化为葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 乙烯能使酸性高锰酸钾溶液褪色,发生了氧化反应
B. 苯在一定条件下能与浓硝酸反应得到硝基苯,发生了取代反应
C. 乙醛在一定条件与氢气反应生成乙醇,发生了还原反应
D. 鸡蛋清溶液中加入饱和硫酸铵溶液、饱和硫酸铜溶液均会发生盐析而凝聚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行实验并得到下表实验结果:
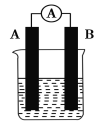
实验序号 | A | B | 烧杯中的液体 | 灵敏电流表指针是否偏转 |
1 | Zn | Zn | 乙醇 | 无 |
2 | Zn | Cu | 稀硫酸 | 有 |
3 | Zn | Cu | 稀硫酸 | 无 |
4 | Zn | Cu | 苯 | 无 |
5 | Cu | C | 氯化钠溶液 | 有 |
6 | Mg | Al | 氢氧化钠溶液 | 有 |
分析上述实验,回答下列问题:
(1)实验2中电流由________极流向________极(填“A”或“B”)。
(2)实验6中电子由B极流向A极,表明负极是________(填“镁”或“铝”)电极。
(3)实验5表明________(填字母序号,下同)。
A.铜在潮湿空气中不会被腐蚀
B.铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是________。
A.金属活动顺序表中,活泼性强的金属一定作负极
B.失去电子的电极是负极
C.烧杯中的液体必须是电解质溶液
D.原电池中,浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种非金属)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知c(NH4Cl)≤0.1mol/L时,溶液pH>5.1。现用0.1 mol/L盐酸滴定10mL0.05 mol/L氨水,用甲基橙作指示剂,达到滴定终点,所用盐酸的体积为
A. 10mL B. 5mL C. 大于5 mL D. 小于5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
实验:向2 mL FeCl2溶液中滴加2滴0.1 molL-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 molL-1、pH约为5(酸性环境)),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示实验中溶液变红的原因: 、 。
(2)甲探究实验中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 molL-1 FeCl3溶液中滴加2滴0.1 molL-1 KSCN溶液,变红,通入O2,无明显变化。
① 实验I说明 ;②实验III说明 。
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com