
| A. | 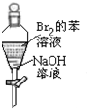 充分振荡后静置,上层溶液颜色保持不变 | |
| B. | 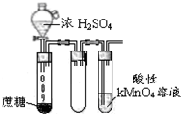 酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| C. | 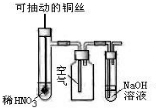 微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 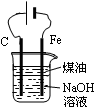 制备Fe(OH)2并能较长时间观察其颜色 |
分析 A.溴与NaOH反应后,与苯分层,苯在上层;
B.浓硫酸具有脱水性,使蔗糖碳化,然后C与浓硫酸反应生成具有还原性的二氧化硫;
C.Cu与稀硝酸反应生成NO,NO与氧气反应生成红棕色的二氧化氮;
D.Fe与电源负极相连,为阴极,不能失去电子.
解答 解:A.溴与NaOH反应后,与苯分层,苯在上层,则充分振荡后静置,上层溶液变为无色,故A错误;
B.浓硫酸具有脱水性,使蔗糖碳化,然后C与浓硫酸反应生成具有还原性的二氧化硫,则酸性KMnO4溶液中出现气泡,且颜色逐渐褪去,故B正确;
C.Cu与稀硝酸反应生成NO,NO与氧气反应生成红棕色的二氧化氮,则广口瓶内由无色变为红棕色,故C错误;
D.Fe与电源负极相连,为阴极,不能失去电子,则图中装置不能制备Fe(OH)2,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、实验装置的作用、实验技能等为解答的关键,侧重分析与实验能力的考查,注意元素化合物、反应原理与实验的结合,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 屠呦呦女士通过研究青蒿素获得了“诺贝尔医学奖”以表彰她对疟疾治疗所做的贡献.那么青蒿素的结构式为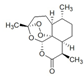 ,分子式为C15H20O5 ,分子式为C15H20O5 | |
| B. | 向鸡蛋清溶液中分别加入(NH4)2SO4和CuSO4溶液都能使鸡蛋清聚沉,其作用原理相同 | |
| C. | 淀粉,纤维素,油脂均能发生水解,同时它们都是高分子化合物 | |
| D. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol•L-1的氨水含有0.1 NA个OH- | |
| B. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| C. | 80℃时,1L pH=1的硫酸溶液中,含有0.2NA个H+ | |
| D. | 在电解精炼粗铜的过程中,当阴极析出32g铜时转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
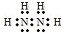 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀氯化钙水溶液中 | B. | 氯化银悬浊液中 | ||
| C. | 二氧化硫与氧气反应的混合物中 | D. | 稀醋酸水溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
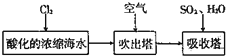
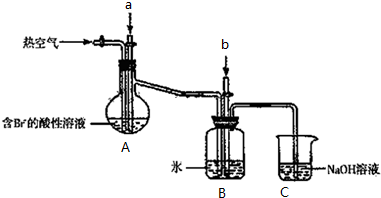
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com