
一定量的锌粉和6mol•L﹣1的过量盐酸反应,当向其中加入少量的下物质:①石墨 ②CuO ③铜粉 ④锌粒 ⑤浓盐酸 ⑥无水乙酸 ⑦KNO3溶液 ⑧CuCl2时,能够加快反应速率,又不响产生H2总量的是( )
|
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑧ | D. | ①⑤⑦ |
考点:
化学反应速率的影响因素.
专题:
化学反应速率专题.
分析:
盐酸过量,则锌完全反应,锌的量决定氢气的体积,能够加快反应速率,又不影响产生H2的总量,采取措施有:形成原电池,注意形成原电池是不能消耗Zn,升高温度,改变锌粉的颗粒大小,增大氢离子的浓度等,以此来解答.
解答:
解:①加入石墨粉,构成原电池,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故①正确;
②加入CuO,与盐酸反应生成氯化铜,氯化铜与锌反应生成铜,形成原电池,加快反应,但与盐酸反应的锌的量减少,生成氢气的总量减少,故②错误;
③加入铜粉,构成原电池,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故③正确;
④加入锌粒,固体表面积减小,反应速率减小,产生H2的总量增大,故④错误;
⑤加入浓盐酸,氢离子浓度增大,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故⑤正确;
⑥无水乙酸,氢离子浓度增大,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故⑥正确;
⑦KNO3溶液,在酸性条件下与锌反应生成NO,不生成氢气,影响生成氢气的总量,故⑦错误;
⑧加入CuCl2,锌置换铜,形成原电池反应,消耗锌,生成氢气的总量减少,生成氢气的速率增大,故⑧错误.
故选B.
点评:
本题考查化学反应速率的影响元素,为高频考点,侧重于学生的分析能力的考查,注意加入氧化铜、Fe粉对氢气总量的影响,是本题的易错点,题目难度中等,


科目:高中化学 来源: 题型:
有机物分子中基团间的相互影响会导致化学性质不同.下列叙述不能说明上述观点的是( )
|
| A. | 甲苯与硝酸作用可得到2,4,6﹣三硝基甲苯,而苯与硝酸作用得到硝基苯 |
|
| B. | 甲苯可以是高锰酸钾溶液退色,而甲烷不能 |
|
| C. | 乙烯可发生加成反应,而乙烷不能 |
|
| D. | 苯酚能与NaOH溶液反应,而乙醇不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在密闭容器中进行反应3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g),能表示上述反应达到化学平衡状态的是( )
Si3N4(s)+12HCl(g),能表示上述反应达到化学平衡状态的是( )
A.3v逆(N2)=v正(H2)
B.v正(HCl)=4v正(SiCl4)
C.混合气体密度保持不变
D.c(N2):c(H2):c(HCl)=1:3:6
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与社会、生活和生产息息相关,以下叙述错误的是( )
|
| A. | 科学家们正在研究利用蓝绿藻等低等植物和微生物在阳光作用下使水分解产生氢气 |
|
| B. | 贮氢金属在一定温度和压强下可以吸附氢气,如镧镍合金(LaNi5)可以吸附氢气形成LaNi5H6,其中H元素以化合态形式存在 |
|
| C. | 生活垃圾送入焚烧炉产生的热量可发电、供暖,焚烧炉产生的气体可直接排放 |
|
| D. | 2013年3月底,H7N9型禽流感在上海和安徽两地率先发现.要杀死禽流感病毒可通过消毒剂杀菌,通过加热煮沸杀菌,也可用紫外线照射杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | ⅠA族元素单质的熔点从上往下逐渐降低 |
|
| B. | 分子晶体中一定存在共价键 |
|
| C. | ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
|
| D. | 同周期非金属氧化物对应的水化物的酸性从左往右依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有下列短周期元素性质的数据,下列说法正确的是( )
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10﹣10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | ﹣2 | +2 | +1 | +5;﹣3 | +7;﹣1 | +1 | +5;﹣3 | +3 |
|
| A. | ⑧号元素为Al |
|
| B. | ②、③处于同一周期 |
|
| C. | 上述八种元素最高价氧化物对应的水化物⑤号酸性最强 |
|
| D. | ④元素的气态氢化物沸点大于⑦元素的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图1的装置:(以下均假设反应过程中溶液体积不变).
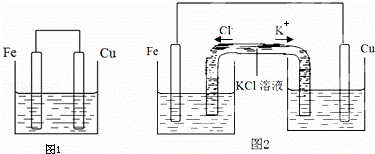
(1)铁片上的电极反应式为 .
(2)铜片周围溶液会出现 的现象.
(3)若2min后测得铁片和铜片之间的质量差为1.2g,计算:
①导线中流过的电子的物质的量为 mol;
②该段时间内用硫酸铜表示的平均反应速率为 mol•L﹣1•min﹣1
(4)若一段时间后测得铁片减少了2.4g,同时铜片增加了3.2g,计算这段时间内该装置消耗的化学能转化为电能的百分比为 .
(5)若将该装置改为如图2所示的装置也能达到和原装置相同的作用.其中KCl溶液起沟通两边溶液形成闭合回路的作用,同时又能阻止反应物直接接触.则硫酸铜溶液应该注入 (填“左侧”、“右侧”或“两侧”)烧杯中.
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂排放的工业废水中可能含有K+、Ag+、NH4+、Mg2+、SO42﹣、Cl﹣、NO3﹣、HCO3﹣等离子.经检测废水呈明显的碱性,则可确定该厂废水中肯定不含有的离子组合是( )
|
| A. | Ag+、K+、NO3﹣、HCO3﹣ | B. | K+、NH4+、NO3﹣、SO42﹣ |
|
| C. | Ag+、NH4+、Mg2+、HCO3﹣ | D. | K+、Mg2+、SO42﹣、Cl﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
2000K时,反应CO(g)+ O2(g)⇌CO2(g)的平衡常数为K,则相同温度下反应2CO2(g)⇌2CO(g)+O2(g)的平衡常数K′为( )
O2(g)⇌CO2(g)的平衡常数为K,则相同温度下反应2CO2(g)⇌2CO(g)+O2(g)的平衡常数K′为( )
|
| A. |
| B. | K2 | C. |
| D. |
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com