

分析 (1)乙醇在铜做催化剂条件下加入反应生成乙醛和水,据此写出反应的化学方程式;熄灭酒精灯,反应仍然能够继续反应,说明该反应为放热反应;
(2)装置甲的作用是将乙醇变成乙醇蒸气,所以需要热水;乙装置是冷却乙醛,需要冷水;
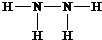
(3)空气中氧气被反应掉,则属于气体的主要成分为氮气,写出氮气的结构式;
(4)乙醛分子中含有醛基,与新制氢氧化铜的悬浊液,观察现象.
解答 解:(1)进入乙中的气体为空气和乙醇,加热时,铜和氧气反应生成氧化铜,方程式为2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,氧化铜和乙醇在加热条件下发生氧化还原反应可生成乙醛和铜,总反应的方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束,说明反应引发后,不需加热即可进行到底,说明该反应是放热的反应,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;放热;
(2)甲装置常常浸在温度为70~80的水浴中,水浴能使容器受热均匀,能使甲中乙醇平稳气化成乙醇蒸气;
乙装置中为冷水浴,使生成的乙醛在乙中经冷却而收集,
故答案为:热水;促使乙醇挥发;冷水;使乙醛冷却;
(3)空气中的氧气参与反应,丙中集气瓶内收集到气体的主要成分氮气,故答案为:N2;
(4)乙醛分子中含有醛基,与新制氢氧化铜的悬浊液,具体操作是取新制氢氧化铜悬浊液,滴加a中物质,加热,有砖红色沉淀生成,故答案为:取新制氢氧化铜悬浊液,滴加a中物质,加热,有砖红色沉淀生成.
点评 本题以乙醇的催化氧化为载体,综合考查学生的分析能力和实验能力,为高考常见题型,注意把握实验的原理以及操作方法,难度中等.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(Na+)>C(HCO3-)>C(CO32-)>C(H+)>C(OH-) | B. | C(Na+)>C[H+]=C[HCO3-]+C[CO32-]+C[OH-] | ||
| C. | C[Na+]+C[H+]=C[HCO3-]+2C[CO32-]+C[OH-] | D. | C[Na+]=C[HCO3-]+C[CO32-] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v (NO)=0.0010 mol•L-1•s-1 | B. | v (O2)=0.0010 mol•L-1•s-1 | ||
| C. | v (NH3)=0.010 mol•L-1•s-1 | D. | v (H2O)=0.045 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2SO4的酸性比H2CO3的强 | B. | Mg(OH)2的碱性比Ca(OH)2的弱 | ||
| C. | HCl、HBr、HI的热稳定性依次增强 | D. | 氯气比氟气更易与氢气发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.l mol•L-1醋酸钙溶液中,c(Ca2+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 等体积等pH的NH4Cl溶液、盐酸,完全溶解少量且等同的锌粉,前者用时少 | |
| C. | 将n mol H2(g)、n mol I2(g)和2n mol H2 (g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 | |
| D. | 某物质的溶液中由水电离出的c(H+)=1×10-a mol•L-1,若a>7时,则该溶液的pH一定为14-a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子组成上相差1个或若干个CH2原子团的有机物互为同系物 | |
| B. | 凡是分子组成相同而结构不同的有机物之间互为同分异构体 | |
| C. | 苯分子中不存在C-C和C=C的事实是分子中六个碳碳键的键长、键角、键能都相等,邻二氯苯没有同分异构体,苯不能被酸性高锰酸钾氧化,苯不与溴水加成 | |
| D. | H2O 和H2O2 互为同素异形体. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com