
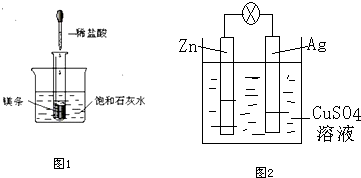
分析 (1)如图所示的实验中,所试管内滴入稀盐酸,盐酸与镁剧烈反应放出氢气,同时反应放出的热量使饱和石灰水溶液温度升高,温度升高氢氧化钙溶解度减小,饱和溶液析出固体氢氧化钙而使烧杯中的溶液变浑浊;
(2)该原电池中,Zn易失电子发生氧化反应而作负极,Ag作正极,负极上电极反应式为Zn-2e-=Zn2+,正极上电极反应式为Cu2++2e-=Cu,据此分析解答.
解答 解:(1)①镁与盐酸剧烈反应,可观察到产生大量气体,镁片逐渐溶解,烧杯中析出晶体氢氧化钙晶体,
故答案为:镁片上有大量气泡,镁片逐渐溶解,烧杯中析出晶体;
②镁与盐酸剧烈反应,产生氢气,该反应为放热反应,氢氧化钙在水中的溶解度随温度的升高而减小
故答案为:镁与盐酸反应产生H2,该反应为放热反应,氢氧化钙在水中的溶解度随温度的升高而减小;
③镁与盐酸发生置换反应,生成氯化镁和氢气,反应的离子方程式为:Mg+2H+=Mg2++H2↑,
故答案为:Mg+2H+=Mg2++H2↑;
(2)锌易失电子发生氧化反应而作负极,电极反应式为Zn-2e-=Zn2+,所以锌片上看到的现象是金属逐渐溶解,总的电极反应式为:Zn+Cu2+=Zn2++Cu,故答案为:锌溶解;负;氧化;Zn-2e-=Zn2+;Zn+Cu2+=Zn2++Cu.
点评 本题考查金属与酸的反应,该反应为放热反应,难度不大.要注意氢氧化钙的溶解度随温度升高而减小,但本题没考到这一点,是一点创新.


科目:高中化学 来源: 题型:选择题
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 加入NaHCO3使氯水的漂白能力增强 | |
| C. | 难溶电解质可以由溶解度小的转化为溶解度更小的,但不能从溶解度小的转化为溶解度大的 | |
| D. | Ksp只受温度的影响,不受浓度的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在其它条件相同时,将等质量的锌块和锌粉与相同浓度的盐酸反应,锌粉反应快 | |
| B. | 将质量相同、形状大小一样的铝条分别与稀硫酸和浓硫酸反应,浓硫酸产生氢气快 | |
| C. | 两支试管中分别加入双氧水,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 | |
| D. | 在稀硫酸和铁粉反应制取氢气时,加入适量醋酸钠晶体,可减慢反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18O只存在于乙酸分子中 | |
| B. | 18O存在于乙酸和乙酸乙酯中分子中 | |
| C. | 18O只存在于乙醇分子中 | |
| D. | 18O存在于水、乙酸分子中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无法确定Al65Cu23Fe12中三种金属的化合价 | |
| B. | Al65Cu23Fe12的硬度小于金属铁 | |
| C. | Al65Cu23Fe12不可用作长期浸泡在海水中的材料 | |
| D. | 1mol Al65Cu23Fe12溶于过量的硝酸时共失去265 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅是良好的半导体材料 | |
| B. | 硅单质可用来制造太阳能电池 | |
| C. | SiO2是制造光导纤维的材料 | |
| D. | 可用带玻璃塞的试剂瓶中盛有NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物水化物的碱性:Y<Z | B. | 简单气态氢化物的热稳定性:X<W | ||
| C. | X分别与Z、W形成化合物的熔点:Z<W | D. | 简单离子的还原性:X<W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com