
| A、IClO |
| B、ICl3 |
| C、I2Cl6 |
| D、KIO3 |
| 12g×36.5% |
| 36.5 |


科目:高中化学 来源: 题型:
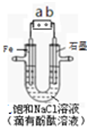 如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )
如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )| A、a为电源的正极 |
| B、通电一段时间后,石墨电极附近溶液先变红 |
| C、Fe电极的电极反应是4OH--4e-═2H2O+O2↑ |
| D、电解饱和食盐水的总反应是:2NaCl+2H2O═2NaOH+H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| B、1mol NH3含有的电子数10NA |
| C、常温常压下,22.4L的氧气含氧原子数为2NA |
| D、常温下,1L 0.1mol?L-1 AlCl3溶液中含Al3+数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硝基苯的结构简式为 |
B、表示甲烷分子或四氯化碳分子的比例模型 |
| C、等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 |
D、结构片段为 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知酸性高锰酸钾溶液可以将FeSO4氧化,方程式为:2KMnO4+10FeSO4+8H2SO4→K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示.则下列有关说法错误的是( )
已知酸性高锰酸钾溶液可以将FeSO4氧化,方程式为:2KMnO4+10FeSO4+8H2SO4→K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示.则下列有关说法错误的是( )| A、图中AB段主要是高锰酸钾和碘化钾溶液反应 |
| B、图中BC段发生的反应为2Fe3++2I-→2Fe2++I2 |
| C、根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25mol |
| D、根据OC段的数据可知开始加入的硫酸亚铁的物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 依据某氧化还原反应设计的原电池如图所示.
依据某氧化还原反应设计的原电池如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 颜色 | Ksp | |
| AgCl | 白色 | 1.8×10-10 mol2?L-2 |
| AgBr | 浅黄色 | 5.0×10-13 mol2?L-2 |
| AgI | 黄色 | 8.3×10-17 mol2?L-2 |
| Ag2CrO4 | 砖红色 | 1.1×10-12 mol3?L-3 |
| HgS | 黑色 | 1.6X10-52 mol2?L-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1装置模拟铁的吸氧腐蚀 |
| B、图2装置制取并吸收NH3 |
| C、图3装置量取8.5mL的稀硫酸 |
| D、图4装置制取少量乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com