
分析 (1)发生的反应有:CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+5H2O↑、CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$CuO+SO3↑、4CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+O2↑ 等,假设产物全部是CuSO4,或者产物全部是CuO,计算固体质量判断组成,再根据质量、Cu元素物质的量列方程计算;
(2)根据4CuO=2Cu2O+O2↑、2SO3  2SO2+O2↑判断;
2SO2+O2↑判断;
(3)最终固体产物为Cu2O,根据2CuSO4•5H2O~Cu2O计算;
(4)假设固体全部为Cu2O,计算其质量,结合(1)中计算判断组成,再根据质量、Cu元素物质的量列方程计算.
解答 解:*(1)发生的反应有:CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+5H2O↑、CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$CuO+SO3↑、4CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+O2↑ 等,n(CuSO4•5H2O)=$\frac{25g}{250g/mol}$=0.1mol,
若产物全部是CuSO4,则m(CuSO4)=0.1mol×160g/mol=16g;
若产物全部是CuO,则m(CuO)=0.1mol×80g/mol=8g,
所以10g固体中含有CuSO4和CuO,设CuSO4和CuO分别为x、y,则:
x+y=0.1mol
160x+80y=10g
解得:x=0.025mol y=0.075mol
则:m(CuSO4)=0.025mol×160g/mol=4g m(CuO)=0.075mol×80g/mol=6g
答:固体产物质量是否可能为10g,其中CuSO4为4g、CuO为6g;
(2)根据反应:CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$CuO+SO3↑,4CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+O2↑,
则有:n(SO3)=n(CuSO4)=0.1mol,n(O2)=$\frac{1}{4}$n(CuO)=$\frac{1}{4}$×0.1mol=0.025mol
则n(SO3)+n(O2)=0.1mol+0.025mol=0.125mol,
又:2SO3$\frac{\underline{催化剂}}{△}$2SO2+O2,若SO3完全分解,则气体的物质的量最多为0.1mol×$\frac{3}{2}$+0.025mol=0.175mol,
所以气体的物质的量准确的范围是0.125<n<0.175,
故选:C;
(3)此反应条件下,最终固体产物为Cu2O,设质量为x,
2CuSO4•5H2O~Cu2O
2×250 144
25.0g x
解得x=7.2g,
答:终固体产物为7.2g,颜色为红色;
(4)若产物全部是CuO,则质量为m(CuO)=0.1mol×80g/mol=8g;
若产物全部是Cu2O,则质量为m(Cu2O)=0.1mol×$\frac{1}{2}$×144g/mol=7.2g,
所以7.6g固体中含有Cu2O和CuO.
设Cu2O和CuO分别为amol、bmol,则:
2a+b=0.1mol
144a+80b=7.6g
解得:a=0.025mo b=0.05mol
即m(Cu2O)=0.025mol×144g/mol=3.6g m(CuO)=0.05mol×80g/mol=4g,
答:Cu2O为3.6g,CuO为4g.
点评 本题考查化学方程式的计算、混合物计算,题目难度较大,侧重考查学生分析计算能力,注意根据物质的性质,结合反应的化学方程式计算.


科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时,用细沙覆盖灭火,镁着火用泡沫灭火器 | |
| B. | 用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则待测结果会偏低 | |
| C. | 测定一包白色粉末的质量,将药品放在右盘,砝码放在左盘 | |
| D. | 除去乙醇中的乙酸可先加入碳酸钠溶液然后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
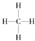 .一定量的该气体燃烧过程的能量变化如图1所示,从图中可以读出E1>E2(填“>”或“<”),该反应放出 (填“放出”或“吸收”)能量.
.一定量的该气体燃烧过程的能量变化如图1所示,从图中可以读出E1>E2(填“>”或“<”),该反应放出 (填“放出”或“吸收”)能量.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-的结构示意图: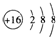 | B. | 中子数为10的氧原子:${\;}_{18}^{8}$O | ||
| C. | HClO的电子式: | D. | 硝基苯的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有①②③⑤⑥ | C. | 只有①②③⑥ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
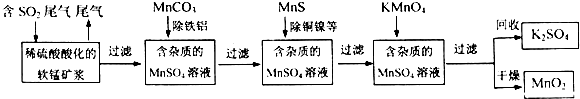
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$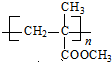 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
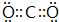 .
.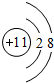 ,D、E结合形成的化合物的电子式
,D、E结合形成的化合物的电子式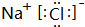 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com