
【题目】分类是化学研究中常用的方法。下列分类方法正确的是
A. 根据溶液酸碱性,将化合物分为酸、碱、盐
B. 根据分散质微粒直径大小,将分散系分为胶体、浊液和溶液
C. 根据水溶液是否导电,将化合物分为电解质和非电解质
D. 根据化合物是否来自于有机体,将化合物分为有机物和无机物
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】10mLNO、CO2的混合气体通过足量的Na2O2后,气体的体积变为6mL(相同状况),则NO和CO2的体积比为( )
A.1:1
B.2:1
C.3:2
D.1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个制取氯气并以氯气为原料进行特定反应的装置,请回答下列问题. 
(1)A是氯气发生装置,其中发生反应的离子方程式为 .
(2)实验开始时,先点燃装置A处的酒精灯,打开弹簧夹K,让Cl2充满整个装置,再点装置D处的酒精灯,Cl2通过C瓶后再进入D(D装置的硬质玻璃管内盛有碳粉)发生氧化还原反应,其产物为CO2和HCl.D中发生反应的化学方程式为 , 装置C的作用是 .
(3)实验过程中,E处产生的现象为 .
(4)D处反应完毕后,关闭弹簧夹K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,此时B中出现的现象是 , 装置B的作用是 .
(5)若实验中使12molL﹣1的浓盐酸10mL与足量的MnO2反应,则生成的Cl2的物质的量总是小于0.03mol,其原因是 .
(6)若要吸收从硬质玻璃管中导出的气体,E中应盛放溶液,其中有毒气体与之反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. N、O、F最高正价依次升高
B. 锂、钠、钾、铷单质与水反应置换出氢气越来越难
C. F2、Cl2、Br2、I2单质的熔点逐渐降低
D. Al3+、Na+、O2-微粒半径依次增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是常温下部分短周期元素,最高价氧化物对应水化物的等物质的量浓度稀溶液的pH值与原子序数的关系图,其中H的氧化物是两性氧化物。下列说法正确的是

A. 元素B对应的氢化物比J对应的氢化物熔沸点更高,原因是B的氢化物中的键能比J中的大。
B. 根据图形分析可知,K、L两种元素最高价氧化物对应的水化物的酸性,前者较强。
C. 晶体IC2熔化时克服的化学键和晶体KC2与水反应时克服的化学键,类型相同。
D. 元素K、H、G分别形成的简单离子的半径逐渐减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氢氧燃料电池进行下图实验(图中所用电极均为惰性电极):

(1)电极a为______极(填“正”或“负”),溶液中OH-移向______极(填“a”或“b”);
(2)电极b处所发生的电极反应方程式为___________________;
(3)随着反应的进行,氢氧燃料电池内部的pH将______(填“增大”或“减小”);
(4)c极为________(填“阴”或“阳”)极,电极反应式为_____________________;
(5)右边装置中盛有足量的 AgNO3溶液,当氢氧燃料电池中消耗氢气1.12L(标准状况下)时,则此时右边装置中________电极质量增加_________g。
(6)若把上图中的氢气换成甲醇,该燃料电池负极电极反应式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经一定时间后,可逆反应aA+bBcC中物质的含量A%和C%随温度的变化曲线如图所示.下列说法正确的是( ) 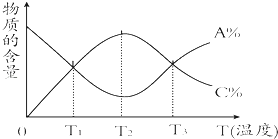
A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com