
| A. | 溴乙烷的消去反应:CH3CH2Br+NaOH$→_{△}^{H_{2}O}$CH2═CH2↑+NaBr+H2O | |
| B. | 苯酚钠溶液中通入CO2:2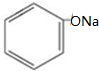 +CO2+H2O→2 +CO2+H2O→2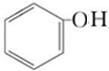 +Na2CO3 +Na2CO3 | |
| C. | 合成聚丙烯塑料:nCH2=CH-CH3$\stackrel{一定条件}{→}$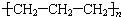 | |
| D. | 乙醛与新制银氨溶液反应:CH3CHO+2Ag(NH3)2OH$\stackrel{水溶液加热}{→}$CH3COONH4+2Ag↓+3NH3+H2O |
分析 A.溴乙烷和氢氧化钠的醇溶液发生消去反应生成乙烯;
B.无论二氧化碳是否过量,二氧化碳和苯酚钠溶液反应都生成碳酸氢钠;
C.丙烯发生加聚反应,双键断开,相连形成高分子化合物;
D.含有醛基的物质能和银氨溶液发生银镜反应.
解答 解:A.溴乙烷和氢氧化钠的醇溶液发生消去反应生成乙烯,反应方程式为CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2═CH2↑+NaBr+H2O,故A错误;
B.无论二氧化碳是否过量,二氧化碳和苯酚钠溶液反应都生成碳酸氢钠,反应方程式为 +CO2+H2O→
+CO2+H2O→ +NaHCO3,故B错误;
+NaHCO3,故B错误;
C.丙烯发生加聚反应,双键断开,相连形成高分子化合物,反应方程式为nCH2=CH-CH3$\stackrel{一定条件}{→}$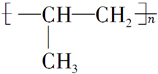 ,故C错误;
,故C错误;
D.含有醛基的物质能和银氨溶液发生银镜反应,乙醛含有醛基,能和银氨溶液发生银镜反应,反应方程式为CH3CHO+2Ag(NH3)2OH$\stackrel{水溶液加热}{→}$CH3COONH4+2Ag↓+3NH3+H2O,故D正确;
故选D.
点评 本题考查化学方程式正误判断,明确物质发生的反应及成键断键方式是解本题关键,有些反应产物与反应条件、反应物浓度及反应物的量有关,易错选项是C.


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
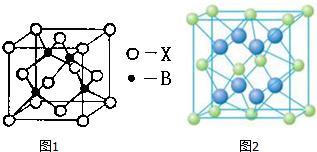
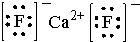 .则晶胞中与A离子距离相等且最近的E离子围成的几何体形状是正方体.
.则晶胞中与A离子距离相等且最近的E离子围成的几何体形状是正方体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雷雨天气时空气中能生成少量的氮氧化物,属于氮的固定 | |
| B. | 实验室用氯化铵溶液和氢氧化钙溶液混合制取氨气 | |
| C. | 铵盐化学性质都很稳定 | |
| D. | O2、NO、NO2都能用浓硫酸干燥,且通常情况下能共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
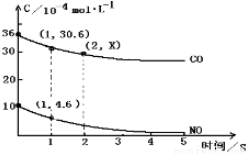
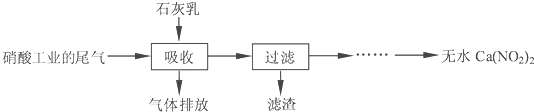
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的状态与反应热有关 | B. | 物质的状态与生成物有关 | ||
| C. | 可以具体说明反应进行的情况 | D. | 可以具体说明反应发生的条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
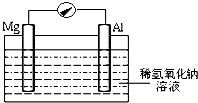 近年来,镁在汽车、航空、航天、机械制造、军事等产业中应用迅猛发展.
近年来,镁在汽车、航空、航天、机械制造、军事等产业中应用迅猛发展.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com