
将溶质的质量分数为14%的KOH溶液加热蒸发掉100 g水后,得到溶质的质量分数为28%的溶液80 mL,此时溶液的物质的量浓度为( )
A.5 mol·L-1 B.6.25 mol·L-1
C.7 mol·L-1 D.6.75 mol·L-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟,应理解为( )
A、单质 B、分子
C、元素 D、氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
将4.48g Fe溶于1L 0.2mol·L-1的稀硫酸,再加入50mL 0.4mo1·L-1KNO3溶液后,其中的Fe2+全部转化成Fe3+,NO3-无剩余,生成一种氮氧化物NYOX。则该氮氧化物的化学式是
A.N2O B.NO C.N2O3 D.NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
A.1L水中溶解了40 g NaOH后,所得溶液浓度为1 mol/L
B.从1L 2 mol/L的NaCl溶液中取出0.5 L,该溶液的浓度为1 mol/L
C.将标准状况下的HCl气体2.24 L通入水中制成100 mL溶液,所得溶液的物质的量浓度为1 mol/L
D.配制1L 0.2 mol/L的CuSO4溶液,需用25 g胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
向50 mL Na2SO4和Na2CO3的混合溶液中加入过量的BaCl2溶液,得到14.51 g白色沉淀,向白色沉淀中加入过量的稀HNO3,充分反应后,沉淀减少到4.66 g,并有气体产生。
(1)原混合溶液中Na2SO4和Na2CO3的物质的量浓度各是多少?
(2)产生的气体的物质的量为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:① 2C(s)+O2(g) = 2CO(g) △H=—221kJ·mol—1
② H+(aq)+OH—(aq) = H2O(l) △H=—57.3kJ·mol—1
下列结论错误的是( )
A. 碳的燃烧热大于110.5kJ·mol—1 B. ①的反应热为 —221kJ·mol—1
C. 稀醋酸和稀NaOH溶液反应生成1molH2O,放出57.3 kJ的热量
D. 稀H2SO4 和稀NaOH溶液反应的中和热为57.3 kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
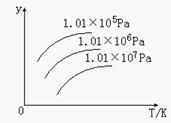
右图表示温度、压强对下列平衡的影响:N2 (g)+3H2(g)  2NH3(g) △H<0
2NH3(g) △H<0
图中y轴表示的意义是( )
A. 正反应速率
B. 平衡混合气体中NH3的含量
C. 平衡混合气体中N2的物质的量
D. H2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 ,第一电离能最小的元素是 (填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
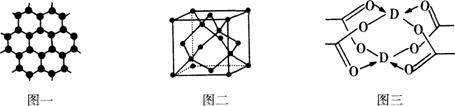 (3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 、另一种的晶胞如图二所示,该晶胞的空间利用率为 ,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 、另一种的晶胞如图二所示,该晶胞的空间利用率为 ,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为 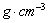 (保留两位有效数字)。(
(保留两位有效数字)。(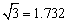 )
)
(4)D元素形成的单质,其晶体的堆积模型为 ,D的醋酸盐晶体局部结构如图
三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出上述过程的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com