
(1)将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
H2NOONH4(s) 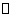 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度( | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度( | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
氨基甲酸铵分解反应的焓变 H__________0(填“>”、“<”或“=”)
H__________0(填“>”、“<”或“=”)
可以判断该分解反应已经达到化学平衡的是____________.(填字母)
A. 2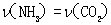
B. 密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D. 密闭容器中氨气的体积分数不变
根据表中数据,计算25.0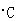 时的分解平衡常数为____________.
时的分解平衡常数为____________.
(2) 25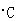 时,NH3·H2O电离常数Kb=1.8
时,NH3·H2O电离常数Kb=1.8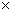 10-5,Mg(OH)2的溶度积常数Ksp=1.8
10-5,Mg(OH)2的溶度积常数Ksp=1.8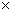 10-11,计算0.5mol/L氨水的pH约为__________.(已知lg3
10-11,计算0.5mol/L氨水的pH约为__________.(已知lg3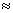 0.5)
0.5)
在某氯化镁溶液中加入一定量的某浓度的氨水后,测得混合液PH=11,则此温度下残留在溶液中的c(Mg2+)=_________________.
【知识点】化学平衡状态的判断、平衡移动、平衡常数的计算 G5 H5
【答案解析】(1)①> (2分) ②BC(3分)(只选一个且正确给1分,出现错误选项不得分)
③1.64×10-8mol3/L3(3分)(数值正确不写单位给2分)
(2)11.5 (3分) 1.8×10-5mol/L (3分),(数值正确不写单位给2分)
解析::(1)①从表中数据可以看出随着温度升高,气体的总浓度增大,平衡正向移动,则该反应为吸热反应,△H>0;
②A、因未指明速率的方向,无法确定正逆反应速率的关系,故A不正确;
B、该反应是气体体积增大的反应,故当容器内压强不变时,已达到平衡,故B正确;
C、由于反应物是固体,没有达到平衡状态,气体质量会变化,容器体积不变,密度也会发生变化,所以密度不变,达到了平衡状态,故C正确;
D、因反应物是固体物质,所以密闭容器中NH3的体积分数始终不变,为2/3,故D错误;
③容器内气体的浓度之比为2:1,故NH3和CO2的平衡浓度分别为3.2×10-3 mol/L、1.6×10-3mol/L,代入平衡常数表达式:K=(3.2×10-3 )2×1.6×10-3=1.64×10-8,
已知氨水电离生成等量的铵根离子和氢氧根离子,NH3•H2O的电离平衡常数、K=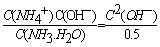 =1.8×10-5所以c(OH)-=3×10-3mol/L,则c(H+)=1/3×10-11, PH=11.5;25℃时,Mg(OH)2的溶度积常数Ksp=1.8×10-11,pH=11.0,c(OH-)=0.001mol/L,残留在溶液中的c(Mg2+)=1.8×10-11/0.0012=1.8×10-5mol/L
=1.8×10-5所以c(OH)-=3×10-3mol/L,则c(H+)=1/3×10-11, PH=11.5;25℃时,Mg(OH)2的溶度积常数Ksp=1.8×10-11,pH=11.0,c(OH-)=0.001mol/L,残留在溶液中的c(Mg2+)=1.8×10-11/0.0012=1.8×10-5mol/L
【思路点拨】本题考查了化学平衡状态的判断,平衡移动、平衡常数的计算,Ksp的应用等,注重了基础知识的应用,学生要加强知识的理解。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
完成下列转化关系中标号反应的化学方程式,并指出反应类型。

①______________________________,________________________________________;
②______________________________,________________________________________;
③______________________________,_________________________________________;
④______________________________,__________________________________________;
⑤______________________________,_________________________________________;
⑥______________________________,_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
芳香族化合物A,分子式为C9H9OCl,且能发生银镜反应;D为含有八元环的芳香族化合物。A与其它物质之间的转化如下图所示:

(1)A的结构简式为 。
(2)A→E的反应条件为 ;C→D的反应类型为 。
(3)写出B→C第①步的反应方程式 。
(4)B的一种同系物F(分子式为C8H8O2)有多种同分异构体,则含有 的芳香族化合物的同分异构体有 种,写出其中核磁共振氢谱有4个峰的一种结构简式 。
的芳香族化合物的同分异构体有 种,写出其中核磁共振氢谱有4个峰的一种结构简式 。
(5)已知: 由甲苯及其它必要物质经如下步骤也可合成B:
由甲苯及其它必要物质经如下步骤也可合成B:

反应I的试剂及条件为 :反应IV所用物质的名称为 ;
反应III的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上消除氮氧化物的污染可用如下反应:
CH4(g)+2NO2(g)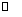 N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g) 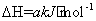
在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的恒容密闭容器中,测得n(N2)随时间变化的数据如下表:
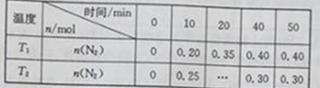
下列说法不正确的是
A. 10min内,T1时的v(N2)比T2时的小
B. T1<T2
C. a<0
D. T2时,若向平衡后的容器中再充入1.2molCH4,重新达到平衡时n(N2)=0.40mol
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的
4种钠盐溶液pH如下表:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中, 正确的是( )
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)> c(H+)>c(HSO3-) >c(SO32-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
NH3是一种重要的化工原料,可以制备一系列物质(如图)。下列说法正确的是 ( )
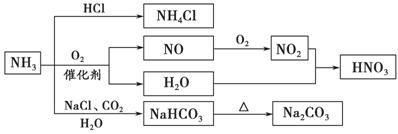
A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl、HNO3和Na2CO3受热时都易分解
C.图中所涉及的盐类物质均可发生水解
D.NH3和NO2在一定条件下可以发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
NaCl是海水中提取出来的一种重要物质,除食用外,它还是一种工业原料,下列以NaCl为原料制得的产品(或物质)是( )
①烧碱 ②纯碱 ③金属钠 ④氯气 ⑤盐酸
A.①②③④⑤ B.①②③④
C.①②③⑤ D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
.下列说法正确的是( )
A.用25ml量筒量取12.3ml盐酸;用托盘天平称取8.75g食盐
B.用pH试纸测得某氯水的pH为2;用标准NaOH溶液滴定未知浓度的盐酸,用去NaOH溶液23.10ml
C.将质量分数为5%和25%的氨水等体积混合后,所得溶液中溶质的质量分数大于15%
D.浓硝酸必须保存在棕色玻璃瓶中;钠必须保存在煤油中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com