
实验室用约10%H2O2溶液100mL,现用市售30% H2O2(密度近似为1g·cm-3)来配制,具体配制方法是 。
科目:高中化学 来源: 题型:
 由短周期元素组成的10种物质A~J之间有下图关系.已知:A、B为同周期相邻元素的单质,其余均为化合物;通常情况下A为固体,B、D为气体且B呈黄绿色,F为液体,A和G的浓溶液加热时反应生成D和F,J在光照时有I生成.
由短周期元素组成的10种物质A~J之间有下图关系.已知:A、B为同周期相邻元素的单质,其余均为化合物;通常情况下A为固体,B、D为气体且B呈黄绿色,F为液体,A和G的浓溶液加热时反应生成D和F,J在光照时有I生成.

 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通 入淀粉KI溶液 |
溶液最初变成 蓝 蓝 色 |
Cl2+2I-=2Cl-+I2 Cl2+2I-=2Cl-+I2 (用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | 5Cl2+I2+6H2O=10HCl+2HIO3 5Cl2+I2+6H2O=10HCl+2HIO3 (用化学方程式表示) |
查看答案和解析>>
科目:高中化学 来源:101网校同步练习 高二化学 山东科学技术出版社 鲁教版 题型:022
实验室进行碘化氢和氯气发生的置换反应,试验步骤如下:
(1)制备碘化氢气体:将10 g干燥的、细碎的晶体碘与1 g干燥的、细碎的白磷,在一定的容器内,一定的环境中互相接触,可发出闪亮的光,然后加水约1 mL,微热.这时产生的气体通过装有黏附着潮湿红磷的短棒玻璃管的U形管后,用向上排空气法收集500 mL气体,这种气体就是碘化氢.
(2)用等口径的250 mL集气瓶,收集氯气(与收集HI时温度压强相等),口对口将500 mL碘化氢气体倒置在装氯气的集气瓶上.迅速抽去集气瓶上的玻璃片,在强光照射下,可观察到碘晶体如紫色的冰片纷纷落下.
(已知:2P+6H2O+3I2=2H3PO4+6HI↑)
回答如下问题:
(1)制备碘化氢气体的装置,与下列哪种实验室制气装置相似________.
A.KClO3和MnO2共热制O2
B.Zn和稀盐酸制H2
C.MnO2和浓盐酸共热制Cl2
D.乙醇与浓硫酸共热制C2H4
(2)使用上述装置制HI时,最好是在装置中充满CO2气体,这是为了________.
(3)制备HI时红磷的作用是________.
(4)写出制磷的化学方程式________.
(5)步骤(2)中氯气放在上方是否合适________(填“合适”“不合适”或“无所谓”).这是因为________.
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
已知理想气体各参数p(压强)、V(体积)、T(温度)、n(物质的量)满足理想气体状态方程pV=nRT。某学校课外活动小组粗略测定理想气体状态方程中气体常数R的值,下面是测定实验的分析报告,请填写有关空白:
(一)测定原理:在理想气体状态方程pV=nRT中,气体常数R=pV/nT的数值可以通过实验来确定。本实验通过金属镁置换出盐酸中的氢来测定R的值。其反应为:
Mg+2HCl=MgCl2+H2↑
如果称取一定质量的镁与过量的盐酸反应,则在一定温度和压力下,可以通过测出反应放出氢气的体积。实验室的温度和压力可以分别由温度计和气压计测得。氢气物质的量可以通过反应中镁的质量来求得。将以上所得各项数据代入R= pV /nT式中,即可算出R值。
 (二)实验用品及试剂:①仪器:托盘天平、测定气体常数的装置(如上图所示);②试剂:6mol·L-1HCl、镁条若干。
(二)实验用品及试剂:①仪器:托盘天平、测定气体常数的装置(如上图所示);②试剂:6mol·L-1HCl、镁条若干。
(三)实验内容:
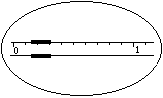
1.在托盘天平上称出镁条的质量(称量镁条天平的游码示数如右图所示,未用砝码,单位为g);
2.按上图搭好仪器。取下试管,移动量气管B,使量气管A中的水面略低于零刻度线,然后将量气管B固定。
3.在试管中加入15mL 6 mol·L-1HCl,不要使盐酸沾湿试管的上半部。将已称重的镁沾少许水,贴在试管上部不与盐酸接触。
4.检查仪器是否漏气,方法如下:(方法要求简单有效)
。
 5.如果装置不漏气,调整量气管B的位置,使量气管A内水面与量气管B 内水面在同一水平面上(要求“在同一水平面上”的原因是 ;实现“在同一水平面上”的操作是 ),然后准确读出量气管A内水面凹面最低点的读数V1(如右图所示)。
5.如果装置不漏气,调整量气管B的位置,使量气管A内水面与量气管B 内水面在同一水平面上(要求“在同一水平面上”的原因是 ;实现“在同一水平面上”的操作是 ),然后准确读出量气管A内水面凹面最低点的读数V1(如右图所示)。
6.轻轻摇动试管,使镁条落入盐酸中,镁条与盐酸反应放出氢气。此时量气管A内水面即开始下降。为了不使量气管A内气压增大而造成漏气,在量气管A内水面下降的同时,慢慢 (上或下)移量气管B,使两管内的水面基本保持水平。反应停止后,待试管冷却至室温(约10分钟),移动量气管B,使两管内的水面相平,读出反应后量气管A内的精确读数V2(如右图所示)。
7.记录实验时的室温t和大气压P。(已知室温为27℃,大气压为100kPa)
(四)数据记录与处理(在横线上填写适当内容):
| 镁条的质量 | w= |
| g |
| 氢气的物质的量 | n= |
| mol |
| 反应前量气管A内读数 | V1= |
| ml |
| 反应后量气管A内读数 | V2= |
| ml |
| 氢气的体积 | V |
| ml |
| 室温 | T |
| K |
| 大气压 | P |
| Pa |
气体常数R的值(计算过程和结果):
(五)问题与讨论:①在读取量气管内气体体积V1时,眼睛仰视读数,结果造成R的测定值 (偏高、偏低或无影响);②若没等反应试管冷却到室温就量取液面的高度,结果造成R的测定值 (偏高、偏低或无影响)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三百校大联考一模考试化学试卷 题型:实验题
(15分)氯酸钾是无机盐工业的重要产品之一,可通过反应:NaC1O3+KC1
KC1O3↓+NaC1制取。
(1)实验室制取氯酸钠可通过反应:3C12+6NaOH 5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。
5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。

(2)工业上制取氯酸钠采用在热的石灰乳通入氯气,然
后结晶除去氯化钙后,再加入一种钠盐,合适的钠盐是
。
(3)北美、欧洲国家生产氯酸钠用二级精制盐水。采用
无隔膜电解法获得,生产过程中涉及的主要的化学反应式如下:
总反应式:NaC1+3H2O NaC1O3+3H2↑
NaC1O3+3H2↑
阳极:2C1——2e—
C12↑阴极:2H2O+2e—
H2↑+2OH—
液相反应:C12+H2O HC1O+H++C1—
HC1O
HC1O+H++C1—
HC1O H++C1O—
H++C1O—
2HC1O+CO— C1O3—+2C1—+2H+
①
精制食盐水时,要除去其中的Ca2+、Mg2+及SO42—并得到中性溶液,依次加入的化学试剂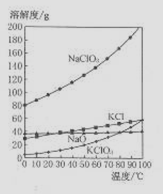
② 是 、 、 ;过滤,滤液中再加入适量的稀盐酸,得一级精制盐水再经离子交换处理或膜处理得到二级精制盐水。
②电解时,必须在食盐水中加入Na2Cr2O2,其目的是防止 (填离子符号)电解过程中在阴极上放电。
(4)若NaC1O2与KC1的混合溶液中NaC1O3与KC1的质量分数分别为0.290和0.203(相关物质的溶解度曲线如右图)。从混合溶液中获得较多KC1O3晶体的实验操作依次
为 (填操作名称)、干燥。
(5)样品中C1O3—的含量可用滴定法进行测定,实验步骤
如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL于锥形瓶中,准确加入25mL1000mol/L(NH4)2Fe(SO4)2。溶液(过量),加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种氧化还原反应指示剂,用0.200mol/LK2Cr2O2标准溶液滴定至终点。
步骤4: 。
步骤5:数据处理与计算。
①步骤2,静置10min的目的是 。
②步骤3中K2Cr2O2标准溶液应盛放在 中(填仪器名称)。
③为了确定样品中C1O2—的质量分数,步骤4的操作内容是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)实验室制备干燥的NH3,根据图甲所示装置回答:
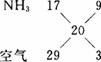
①反应的化学方程式为___________,实验中不选用NaOH制备NH3的原因是______________ ______________________________________,装置中收集NH3的试管口放置棉花团的作用是___________________________________________________________________。
②在a、c之间安装b,是否有必要?___________(填“有”或“没有”),若“有”,应装入___________试剂;(若“没有”,可不答此问)若“没有”,理由是_______________________________________。
(2)实验室欲快速制取大量NH3,根据图乙所示装置回答:
①用化学方程式表示,浓氨水滴入CaO中有大量NH3逸出的原理_______________________。
②检验NH3是否收集满的方法是_______________________________________________。
③测得用排空气法收集到一烧瓶NH3的质量是相同状况下相同体积的H2质量的10倍,若将该烧瓶中NH3做喷泉实验,实验完毕后,烧瓶中水约上升到烧瓶容积的__________(填“几分之几”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com