
| A. | 3.36 L | B. | 6.72 L | ||
| C. | 大于3.36 L,小于5.60 L | D. | 大于5.60 L,小于6.72 L |
分析 电解混合溶液时,阴极发生Cu2++2e-=Cu,析出19.2g Cu,铜的物质的量为:0.3mol,可知阴极得到0.6mol电子,阳极发生:2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,结合两极转移电子数目相等和电极方程式计算.
解答 解:阴极发生Cu2++2e-=Cu,析出19.2g Cu,铜的物质的量为:0.3mol,可知阴极得到0.6mol电子,
阳极发生:2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,氯离子完全析出时,生成n(Cl2)=0.2mol,转移电子0.4mol,
则生成氧气转移电子0.2mol,生成氧气0.05mol,
所以阳极共生成(0.2+0.05)mol=0.25mol气体,
气体体积=0.25mol×22.4L/mol=5.6L,考虑 Cl2部分溶解,所以气体体积小于5.60 L,故选C.
点评 本题以电解原理为载体考查了物质的量的有关计算,明确阳极上析出气体的成分再结合转移电子相等即可解答,题目难度中等.


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 构成电池的两极必须是活泼性不同的金属 | |
| B. | 锌锰干电池工作时,锌作负极 | |
| C. | 在电池中,电子流出的一极是负极,发生还原反应 | |
| D. | 铅蓄电池工作时,电子由Pb电极流出经过溶液后流向PbO2电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤中含有苯和甲苯,可用分馏的方法把它们分离出来 | |
| B. | 煤气的主要成分是丁烷 | |
| C. | 石油是混合物,其分馏产品汽油为纯净物 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
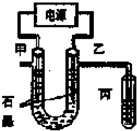 CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu(H2O)42+(蓝色)+4Cl-?CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题:
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu(H2O)42+(蓝色)+4Cl-?CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
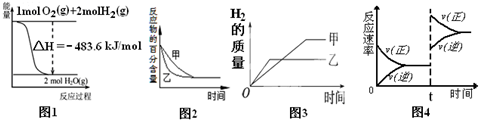
| A. | 图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ/mol | |
| B. | 图2表示压强对可逆反应2A(g)+2 B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 | |
| C. | 图3表示等质量的钾、钠分别与足量水反应,则甲为钠 | |
| D. | 图4表示达到化学平衡后,在t时刻增加了反应物的浓度后,正逆反应速率的变化情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂化主要得到乙烯 | |
| B. | 石油分馏是化学变化,可得到汽油、煤油 | |
| C. | 煤的干馏是化学变化,可以得到出炉煤气、煤焦油和焦炭 | |
| D. | 煤的气化是物理变化,是高效、清洁地利用煤的途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
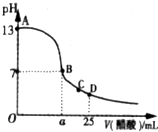 在25mL的氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示.
在25mL的氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:M>Y | B. | 对应氢化物的沸点:M>Z | ||
| C. | 对应氢化物的稳定性:X>Y | D. | XY2与MY2溶于水都能得到对应的酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com