
【题目】已知:CH4(g)+2O2(g)→CO2(g)+2H2O(g) ΔH=-Q1;
2H2(g)+O2(g)=2H2O(g) ΔH=-Q2;
H2O(g)=H2O(l) ΔH=-Q3
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
A.4Q1+0.5Q2 B.4Q1+Q2+10Q3 C.4Q1+2Q2 D.4Q1+0.5Q2+9Q3
【答案】D
【解析】已知:①、CH4(g)+2O2(g)→CO2(g)+2H2O(g) ΔH=-Q1;
②、2H2(g)+O2(g)=2H2O(g) ΔH=-Q2;
③、H2O(g)=H2O(l) ΔH=-Q3
根据盖斯定律,①+2×③得CH4(g)+2O2(g)→CO2(g)+2H2O(l) △H═-Q1-2Q3,
根据盖斯定律,②+2×③的2H2(g)+O2(g) == 2H2O(l) △H═-Q2-2Q3,
112L体积比为4:1的甲烷和H2的混合气体的物质的量为![]() =5mol,
=5mol,
故甲烷的物质的量我5mol×![]() =4mol,
=4mol,
完全燃烧生成液体水放出的热量为(Q1+2Q3)×![]() =4(Q1+2Q3),
=4(Q1+2Q3),
氢气的物质的量为5mol-4mol=1mol,
完全燃烧生成液体水放出的热量为(Q2+2Q3)×![]() =0.5(Q2+2Q3),
=0.5(Q2+2Q3),
故甲烷、氢气完全燃烧,放出的热量为:4(Q1+2Q3)+0.5(Q2+2Q3)=4Q1+0.5Q2+9Q3,故选D。


科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的叙述符合事实的是
A. 乙烯使溴水和酸性高锰酸钾溶液褪色的反应都属于氧化反应
B. 乙酸和乙醇均能与NaOH溶液发生反应
C. 苯与溴水混合后加入FeBr3做催化剂,可发生取代反应生成溴苯
D. C5H11Br有8种同分异构体,它们的熔点、沸点各不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学课外研究小组为研究浓硫酸与金属M 反应的气体生成物,进行了下列实验活动:
【提出假设】
假设1:气体生成物只有SO2;
假设2:气体生成物只有H2;
假设3:_______________________________________。
【实验验证】实验装置及实验中使用的试剂如图:

在装入药品前,甲同学检查装置A 的气密性,方法是________________________________________。
(2)乙同学通过所学知识排除了上面提出的一个假设,他排除的是假设_____,理由是______________________________________________________。
(3)如果假设3 正确,填写下表中的实验现象:
装置 | B | F | G |
实验现象 | _____ | _____ | _____ |
装置C 的作用是___________________________,写出装置C中发生反应的离子方程式__________________________________________________。
(5)装置D 的作用是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),达到平衡,若其它条件不变,将体积压缩至原来的1/2,达到新的平衡后,下列有关该体系的说法不正确的是( )
2CO(g)+2H2(g),达到平衡,若其它条件不变,将体积压缩至原来的1/2,达到新的平衡后,下列有关该体系的说法不正确的是( )
A.正、逆反应速率都加快 B.氢气的浓度与原平衡比减少
C.甲烷的物质的量增加 D.重新平衡时c(CO2) /c(CO)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3(aq)与盐酸反应过程中的能量变化示意图如下,下列选项正确的是
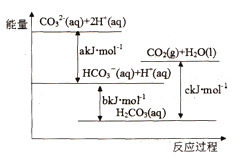
A. H2CO3(aq)=CO2(g)+H2O(l)为放热反应
B. CO32-(aq)+ H+(aq)=HCO3-(aq) △H=akJ/mol
C. HCO3-(aq)+H+(aq)= CO2(g)+H2O(l) △H=(c-b)kJ/mol
D. CO32-(aq)+ 2H+(aq)= CO2(g)+H2O(l) △H=(a+b-c)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 将少量SO2气体通入Ba(OH)2溶液中,有白色沉淀生成
B. 将SO2气体通入BaCl2溶液中,有白色沉淀生成
C. 将SO2气体通入用硝酸酸化过的BaCl2溶液中,有白色沉淀生成
D. 将硝酸酸化的BaCl2溶液加入某溶液中有白色沉淀产生,不能判断该溶液中一定存在SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
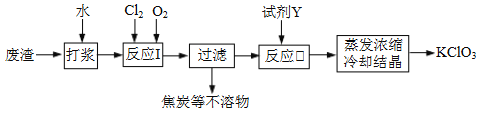
【题目】实验室以一种工业废渣(含80%~90%的Ca(OH)2,其余为焦炭等不溶物)为原料制备KClO3的实验过程如下:
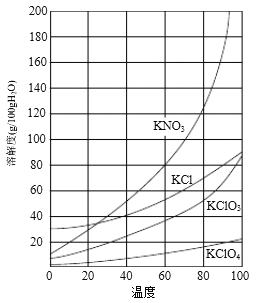
几种物质的溶解度如下图:
⑴反应I的目的是制备Ca(ClO3)2,写出该反应的化学方程式:_____________;在通入Cl2和O2比例、废渣量均一定的条件下,为使Cl2转化完全,可采取的合理措施是____________。
⑵若过滤时滤液出现浑浊,其可能的原因是_____________(填序号)。
A.漏斗中液面高于滤纸边缘 B.滤纸已破损 C.滤纸未紧贴漏斗内壁
⑶所加试剂Y选用KCl而不用KNO3的原因是_____________。
⑷已知:4KClO3![]() 3KClO4 +KCl;2KClO3
3KClO4 +KCl;2KClO3![]() 2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。
2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。
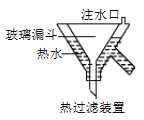
①热过滤装置中玻璃漏斗的下端露出热水浴部分不宜过长,其原因是_____________。
②请补充完整由KClO3制备高纯KClO4固体的实验方案:
向坩埚中加入一定量的KClO3,_____________,在低温下干燥得KClO4固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,容积为2L的密闭容器中,将2molM气体和3molN气体混合,发生下列反应:2M(g) + 3N(g)![]() xQ(g) + 3R(g),该反应达到平衡时生成2.4molR,并测得Q浓度为0.4 mol·L-1,下列叙述正确的是
xQ(g) + 3R(g),该反应达到平衡时生成2.4molR,并测得Q浓度为0.4 mol·L-1,下列叙述正确的是
A. X值为2 B. 容器内压强不变
C. 平衡时N的浓度为0.6mol/L D. M的转化率为80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com