
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白(涉及表中元素一律用对应化学符号表示):
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:________(填具体元素符号,下同),原子结构示意图为________。元素⑩名称为________在周期表中的位置________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是________,碱性最强的化合物的电子式是:________。
(3)用电子式表示元素④与⑥的化合物的形成过程:________________,该化合物属于________(填“共价”或“离子”)化合物。
(4)表示①与⑦的化合物的电子式________,该化合物是由________(填”极性”、“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是______________。
(6)元素③的氢化物的结构式为________;该氢化物常温下和元素⑦的单质反应的化学方程式为_________ _____。
【答案】(1)Ar  溴 第四周期第ⅦA族
溴 第四周期第ⅦA族
(2)HClO4 ![]()
(3)![]() 离子
离子
(4)  极性(5)S2->Cl->O2-
极性(5)S2->Cl->O2-
(6)H—O—H Cl2+H2O===HClO+HCl
【解析】
试题分析:根据元素周期表分析,①为碳,②为氮,③为氧,④为钠,⑤为铝,⑥为硫,⑦为氯,⑧为氩,⑨为钾,⑩为溴。
(1)这些元素中氩化学性质最不活泼,其原子结构示意图为  元素⑩为溴,在元素周期表的第四周期第ⅦA族。(2)高氯酸是最强酸,化学式为HClO4 ,碱性最强的为氢氧化钾,电子式为:
元素⑩为溴,在元素周期表的第四周期第ⅦA族。(2)高氯酸是最强酸,化学式为HClO4 ,碱性最强的为氢氧化钾,电子式为: ![]()
(3)用电子式表示硫化钠的形成过程为: ![]() ;硫化钠含有离子键,属于离子化合物。(4)碳和氯形成四氯化碳,其电子式为
;硫化钠含有离子键,属于离子化合物。(4)碳和氯形成四氯化碳,其电子式为  含有极性键。(5)氧离子,硫离子,和氯离子的比较,氧离子有2层,硫离子和氯离子有3层,层数相同,核电荷数越大,半径越小,层数越多,半径越大,故半径顺序为S2->Cl->O2-。(6)氧元素形成的氢化物为水,结构式为:H—O—H,水和氯气反应生成盐酸和次氯酸,方程式为:Cl2+H2O===HClO+HCl(用
含有极性键。(5)氧离子,硫离子,和氯离子的比较,氧离子有2层,硫离子和氯离子有3层,层数相同,核电荷数越大,半径越小,层数越多,半径越大,故半径顺序为S2->Cl->O2-。(6)氧元素形成的氢化物为水,结构式为:H—O—H,水和氯气反应生成盐酸和次氯酸,方程式为:Cl2+H2O===HClO+HCl(用![]() 也对,2分)
也对,2分)


科目:高中化学 来源: 题型:
【题目】硝基苯是重要的化工原料,用途广泛。制备反应如下:
![]()

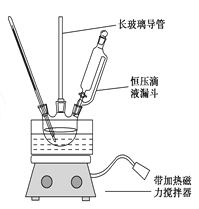
组装如右上图反应装置。 制备、提纯硝基苯流程如下:

可能用到的有关数据列表如下:
物 质 | 熔点/℃ | 沸点/℃ | 密度(20 ℃)/g · cm-3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
浓硝酸 | — | 83 | 1.4 | 易溶于水 |
浓硫酸 | — | 338 | 1.84 | 易溶于水 |
请回答下列问题:
(1)配制混酸应在烧杯中先加入 ;实验装置中长玻璃管最好用________代替(填仪器名称);恒压滴液漏斗的优点是 。
(2)反应温度控制在50~60 ℃的原因是 ;反应结束后产物在 层(填“上”或者“下”),步骤②分离混酸和产品的操作名称是 。
(3)用Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? 。
(4)固体D的名称为 。
(5)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示 )反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀。如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl 。
下列说法不正确的是( )

A. 腐蚀过程中,负极 a被氧化
B. 环境中的Cl-扩散到孔口,并与正极反应产物和负极
反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓
C. 若生成 2.145gCu2(OH)3Cl,则理论上消耗标准状况氧气体积为 0.448L
D. 正极的电极反应式为: 正极反应是 O2+ 4e-+2H2O=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙烯为原料合成化合物C的流程如图所示:

(1)A和B中含有的官能团名称分别为___ _____,____________。
(2)写出A的结构简式:____________ ___________。
(3)①③的反应类型分别为______ __反应和____ ____反应。
(4)写出乙醇的同分异构体的结构简式:______________ ______。
(5)写出反应②和③的化学方程式:
②____________________________;④_____________________________。
(6)写出B与新制Cu(OH)2悬浊液反应的化学方程式:_____ ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药、陶瓷釉药等。钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下:
又已知:①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ba(NO3)2晶体的分解温度:592℃;
③KSP(BaSO4)=1.1×10-10,KSP(BaCO3)=5.1×10-9。

(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。试用离子方程式说明提纯原理:
。
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,反应的化学方程式为: 。
(3)该厂结合本厂实际,选用的X为 (填序号);
A.BaCl2 B.BaCO3 C.Ba(NO3)2 D.Ba(OH)2
(4)中和I使溶液的p H为4~5目的是 ;结合离子方程式简述原理 。
(5)从Ba(NO3)2溶液中获得其晶体的操作方法是 。
(6)测定所得Ba(NO3)2晶体的纯度:准确称取W克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国是世界炼锌的发源地,宋应星著于明崇祯十年(1637年)的《天工开物》一书则是最早记述炼锌技术的典籍。回答下列问题:
Ⅰ.《天工开物》中有关于“升炼倭铅” 的记载:“炉甘石(碳酸锌)十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅(金属锌)也。”
(1)该炼锌工艺过程主要反应的化学方程式为 。
Ⅱ. 目前,工业上主要采用 “湿法炼锌”。以闪锌矿(主要成分为 ZnS ,含有FeS等杂质)为原料冶炼锌的工艺流程如下图所示。

(2)闪锌矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的成分的化学式为 。
(3)焙烧过程中产生的含尘烟气可净化制酸,该酸的名称是 。
工业上常采用“针铁矿法”净化浸出液,在80~100℃,Fe3+浓度低于1g/L,调节浸出液的pH在3~5之间,溶液中的铁可以呈针铁矿(FeOOH)的形式析出。
(4)浸出液的Fe3+浓度较高,应先加入SO2或ZnS将 ,再以ZnO调节酸度,在空气缓慢氧化得 Fe3+,最后Fe3+ 转化成针铁矿沉淀。Fe2+沉淀过程的总离子方程式为 。
(5)电解沉积锌是以Pb-Ag合金惰性电极作阳极、纯铝板作阴极,通以直流电,在 上析出金属锌,电解过程的化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中不考虑两球的浮力变化)

A.杠杆为导体或绝缘体时,均为B端高A端低
B.杠杆为导体或绝缘体时,均为B端低A端高
C.当杠杆为导体时,B端低A端高;杠杆为绝缘体时,B端高A端低
D.当杠杆为导体时,B端高A端低;杠杆为绝缘体时,B端低A端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修2:化学生活与技术]以黄铁矿为原料,采用接触法生产硫酸的流程可简示如下:

请回答下列问题:
(1)在炉气制造中,生成SO2的化学方程式为_________________________________________;
(2)炉气精制的作用是将含SO2的炉气________、________及干燥,如果炉气不经过精制,对SO2催化氧化的影响是___________________________________________;
(3)精制炉气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强关系如下图所示。在实际生产中,SO2催化氧化反应的条件选择常压、450 ℃左右(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是____________。

(4)在SO2催化氧化设备中设置热交换器的目的是________,从而充分利用能源。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种烃,其球棍模型如下图:

(1)等质量的以上物质完全燃烧时耗去O2的量最多的是________(填对应字母,下同);
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是____________;
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是________,生成水最多的是________。
(4)在120℃、1.01×105 Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com