
【题目】(1)写出以下反应的化学反应方程式
①三氧化二铁与稀硫酸反应:______
②氢氧化铝药物治疗胃酸(主要成分为盐酸)过多:______
③氢氧化钠溶液吸收少量二氧化硫气体:______
(2)已知CO和CO2的混合气体18.0g在标准状况下所占的体积为11.2L。则该混合气体中,CO2的物质的量为____mol。
(3)在同温同压下,若A容器中的O2和B容器中的SO2所含的氧原子总数相等,则A容器和B容器的体积比是____。
【答案】Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 3HCl+Al(OH)3=AlCl3+3H2O 2NaOH+SO2=Na2SO3+H2O 0.25 1:1
【解析】
①三氧化二铁为碱性氧化物,能与稀硫酸反应生成硫酸铁和水,其反应的化学反应方程式为:. Fe2O3+3H2SO4=Fe2(SO4)3+3H2O ;答案:. Fe2O3+3H2SO4=Fe2(SO4)3+3H2O ;
②氢氧化铝为两性氧化物,能和盐酸反应生成氯化铝和水,其反应的化学反应方程式为:3HCl+Al(OH)3=AlCl3+3H2O:答案:3HCl+Al(OH)3=AlCl3+3H2O;
③二氧化硫气体为酸性氧化物,能和氢氧化钠溶液反应生成亚硫酸盐和水,其反应的化学反应方程式为:2NaOH+SO2=Na2SO3+H2O;答案:2NaOH+SO2=Na2SO3+H2O。
(2)设CO的物质的量为Xmol,CO2的物质的量为Ymol,根据已知18X+44Y=18
(X+Y)![]() 22.4=11.2,解得X=0.25 Y= 0.25所以混合气体中,CO2的物质的量为0.25mol;答案:0.25;
22.4=11.2,解得X=0.25 Y= 0.25所以混合气体中,CO2的物质的量为0.25mol;答案:0.25;
(3)同温同压下,气体的Vm相等,由n=N/NA=V/Vm,可以知道,若A容器中O2和B容器中O2所含分子总数相等,则体积相等,体积比值为1:1。答案:1:1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】1993年8月,国际原子量委员会确认我国张青莲教授测定的锑的相对原子质量(121.760)为标准原子量,已知锑有两种以上天然同位素,则121.760是( )
A.锑元素的质量与12C原子质量1/12的比值
B.一个锑原子的质量与12C原子质量1/12的比值
C.按各种锑的天然同位素的相对原子质量与这些同位素所占的一定百分比计算出的平均值
D.按各种锑的天然同位素质量数与这些同位素所占的一定百分比计算出的平均值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应的速率、限度及能量变化具有重要意义。
⑴实验室用锌粒和稀硫酸反应制氢气,能加快反应速率的方法有:______、______。
⑵工业上合成氨反应(N2+3H2![]() 2NH3)中物质的能量随时间的变化如下图所示。
2NH3)中物质的能量随时间的变化如下图所示。
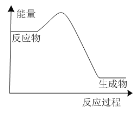
①该反应为______(填“放热”或“放热”)反应。
②若起始N2和H2的体积比为1∶3,控制一定的条件,___(填“能”或“不能”)使反应物的转化率达到100%。
③下列过程放出热量的是______。(填字母)
A.甲烷燃烧
B.碳酸钙分解
C.液氨汽化
D.化学键断裂
⑶图为铜锌原电池示意图。
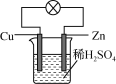
①原电池工作时的能量转化方式为______。
②原电池工作时,导线中电子的流向为______。
③Cu电极表面的现象为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢毒性很大,俗称“一口闷”,工业废水中的硫化物在酸性条件下会以硫化氢的形式逸出。某课外小组以碘量法测定废水中的硫化物,实验装置如图所示,实验步骤及测定原理如下:

Ⅰ.取样、吹气、固硫
连接装置,打开氮气源,检查装置气密性。移取一定体积1mol·L-1乙酸锌溶液于两支吸收管中,取200mL水样于反应瓶中,通入氮气一段时间。移取10mL盐酸于反应瓶中,水浴加热,继续通入氮气。已知乙酸锌与硫化氢反应生成硫化锌沉淀(硫化氢被完全吸收)。
Ⅱ.滴定
关闭气源,往两个吸收管中各加入0.010mol·L-1的碘标准溶液100mL(过量),再加入盐酸5mL,静置。加入淀粉指示液,用0.010mol·L-1的硫代硫酸钠标准溶液对两支吸收管中的液体进行滴定。
(已知:![]() )
)
回答下列问题:
(1)反应瓶中前后通入氮气的目的分别是________________、_________________。
(2)加入碘标准溶液时,吸收管中发生反应的化学方程式为________________。
(3)该实验使用两个吸收管的原因是____,若只使用一个吸收管,会导致测定结果偏____(填“高”或“低”)。
(4)实验室常用FeS固体与酸常温下反应制取H2S。实验室制取H2S时,从反应物与生成物的状态、性质和反应条件分析,下列发生装置中可选用的是_______________(填序号)。
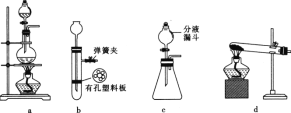
(5)上图a中盛装液体药品的玻璃仪器名称为________。
(6)将二氧化氯溶液加入硫化氢溶液中,然后加入少量稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成。写出二氧化氯与硫化氢溶液反应的离子方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.常温常压下,8gO2含有8NA个质子
B.分子总数为NA的CO2和NO2混合气体中含有的氧原子数为2NA
C.标准状况下,22.4L盐酸含有NA个HC1分子
D.分子总数为NA的CO、N2混合气体体积约为22.4L,质量为28g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲用98%的浓H2SO4(ρ=1.84g/cm3)配制成500mL 0.5mol/L的稀H2SO4,下列说法正确的是
①所需浓H2SO4的体积为13.6mL,可选用20mL量筒量取
②稀释浓硫酸应酸加入水中,且之后立即转移到容量瓶中并加水定容
③为减小误差,应洗涤所用烧杯、玻璃棒和量筒,并将洗涤液转入容量瓶
④定容时俯视,则所配制的溶液浓度偏高
⑤实验中用量筒量取浓硫酸时,仰视读数,则所配制的溶液浓度偏低
A.①③⑤B.②③④C.①④D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列实验装置图,试回答下列问题:

(1)下列实验需要在哪套装置中进行(填序号):
①除去粗盐中的泥沙____;
②与海水晒盐原理相似的是____;
③用四氯化碳从碘水中提取碘____;
④分离互溶的CCl4(![]() 沸点:76.75℃)
沸点:76.75℃)![]() 和苯(
和苯(![]() 沸点:110.6℃)
沸点:110.6℃)![]() 的液体混合物___;
的液体混合物___;
(2)写出以上装置中可被加热的仪器名称为___,需要使用前验漏的玻璃仪器的名称__。
(3)如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),回答下列问题:
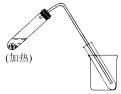
①左边大试管中要加入几片碎瓷片,其作用是____;
②该装置中使用的玻璃导管较长,其与如图③中哪种仪器作用相当____;
③烧杯中还要盛有的物质是____。
(4)下列对离子检验的实验过程评价正确的是(_____)
A.某不溶性固体中加入稀盐酸,产生了无色气体,证明该固体一定是CaCO3
B.某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含SO42-
C.某无色溶液中滴入无色酚酞显红色,该溶液一定显碱性
D.验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加AgNO3溶液,有白色沉淀出现,证明含Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
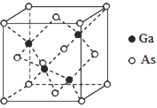
【题目】太阳能电池可分为:硅太阳能电池,化合物太阳能电池,如砷化镓(GaAs)、铜铟镓硒(CIGS)、硫化镉(CdS),功能高分子太阳能电池等,Al-Ni常作电极。据此回答问题:
(1)镍(Ni)在周期表中的位置为______;S原子的价电子排布式为________;Ga、As和Se的第一电离能由大到小的顺序是________。
(2)Na3As3中As原子的杂化方式为_____;AsCl3的空间构型为____。
(3)GaAs熔点为1238℃,GaN熔点约为1500°,GaAs熔点低于GaN的原因为__________。
(4)写出一种与SO42-互为等电子体的分子_________。
(5)GaAs的晶胞结构如图所示,其中As原子形成的空隙类型有正八面体形和正四面体形,该晶胞中Ga原子所处空隙类型为_____。已知GaAs的密度为ρg/cm3,Ga和As的摩尔质量分别为 MGa g/mol和MAsg/mol,则GaAs晶胞中Ga之间的最短距离为________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
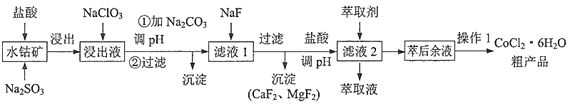
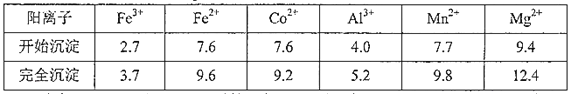
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Al3+、Mn2+、Ca2+、Mg2+等
②部分阳离子开始沉淀和完全沉淀的pH见下表
③CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定,加热至110~120℃时失去结晶水变成无水氯化钴。
(1)写出Co2O3与Na2SO3和盐酸反应的离子方程式______________________。
(2)加入NaClO3的目的是______________________;加入过量NaClO3可能生成有毒气体,该气体是___________(填化学式)
(3)为了除去Fe3+、Al3+,需加Na2CO3调pH,则pH应控制的范围为_____________________.
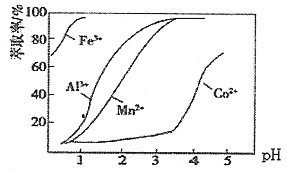
(4)加萃取剂的目的是___________;金属离子在萃取剂中的萃取率与pH的关系如图,据此分析pH的最佳范图为___________(填字母序号)。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(5)CoCl2·6H2O常用减压烘干法烘干,原因是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com