
分析 X、Y为1~20号元素,它们的原子次外层都有8个电子,X元素的最高正价和负价的代数和为6,则X的最高价为+7价,最低价为-1价,X为ⅤⅡA族元素,F无正价,则X只能为Cl;X与Y能形成化合物YX2,电离时形成的两种离子具有相同的电子层结构,Y失去2个电子后形成18电子结构,以此来解答.
解答 解:X、Y为1~20号元素,它们的原子次外层都有8个电子,X元素的最高正价和负价的代数和为6,则X的最高价为+7价,最低价为-1价,X为ⅤⅡA族元素,F无正价,则X只能为Cl,名称为氯;X与Y能形成化合物YX2,电离时形成的两种离子具有相同的电子层结构,Y失去2个电子后形成18电子结构,Y的原子序数为18+2=20,则Y为Ca,名称为钙,
故答案为:氯;钙.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质、原子结构来推断元素为解答本题关键,侧重分析与应用能力的考查,注意次外层电子数为8的元素位于三或四周期,题目难度不大.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:解答题
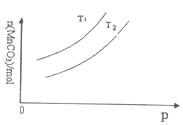
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若管道漏气遇氨就会产生白烟 | |
| B. | 生成1 mol N2有3 mol电子转移 | |
| C. | 发生氧化反应与还原反应的分子个数比是2:3 | |
| D. | 该反应利用了Cl2的强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
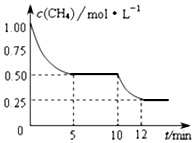 在1L密闭容器中进行反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)的变化如图所示.
在1L密闭容器中进行反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
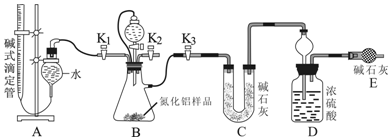
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
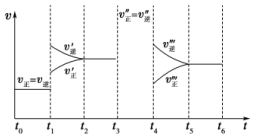 密闭容器中发生如下反应:A(g)+3B(g)?2C(g)△H<0,根据下列速率-时间图象,回答下列问题.
密闭容器中发生如下反应:A(g)+3B(g)?2C(g)△H<0,根据下列速率-时间图象,回答下列问题. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×l0-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | NaHCO3溶液中,c(Na+)>c(HCO3-)>c(H2CO3)>c(OH-) | |
| B. | 将amol•L-1HCN溶液与amol•L-1NaOH溶液等体积混合后,测得所得溶液显碱性,则c(CN-)>c(Na+) | |
| C. | 等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) | |
| D. | 1.0 mol•L-1Na2CO3溶液:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
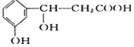 ,它可以发生反应的类型有( )
,它可以发生反应的类型有( )| A. | ①②③④ | B. | ①②⑤⑥ | C. | ①②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com