
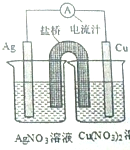
 某同学用铜片,银片,Cu(NO3)2溶液,AgNO3溶液,导线和盐桥(装有琼脂-KN03的U形管)设计一个原电池如图所示,下列判断中正确的是( )
某同学用铜片,银片,Cu(NO3)2溶液,AgNO3溶液,导线和盐桥(装有琼脂-KN03的U形管)设计一个原电池如图所示,下列判断中正确的是( )| A. | 实验过程中,左右两侧烧杯中,NO3-浓度变化情况分别为不变,增大 | |
| B. | 实验过程中,取出盐桥,该原电池也能继续工作 | |
| C. | 若开始使用U形铜管代替盐桥,装置中有电流产生,铜管质量不变 | |
| D. | 若开始时用U形铜管代替盐桥,装置中无电流产生 |
分析 原电池中,铜易失电子作负极,负极上失电子发生氧化反应,银作正极,正极上得电子发生还原反应,阴离子向负极移动以及电化学装置的分析.
解答 解:该原电池中,铜易失电子作负极,银作正极,
A.实验过程中,NO3-向负极铜电极移动,所以左侧烧杯中浓度增大,故A错误;
B.实验过程中取出盐桥,该装置不能形成闭合回路,所以原电池不能继续工作,故B错误;
C.若开始时用U形铜代替盐桥,则右侧构成电解池,左侧构成原电池,U型铜电极反应式从左向右依次为:Cu2++2e-=Cu、Cu-2e-=Cu2+,所以U型铜质量不变,故C正确;
D.若开始时用U形铜代替盐桥,则右侧构成电解池,左侧构成原电池,故D错误;
故选C.
点评 本题考查了原电池和电解池,明确原电池的构成条件、原电池原理及电解池原理是解本题关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 0.1mol Na2O2固体中阳离子与阴离子的总数为0.4NA | |
| B. | 46g NO2和N2O4的混合气体中含有的氧原子数为2NA | |
| C. | 1mol Fe与硫恰好完全反应时,转移电子数一定为3NA | |
| D. | 标准状况下,1mol CH4与过量的氯气发生取代反应,生成CH3Cl气体的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cu是还原剂,被腐蚀 | B. | Fe2+是氧化产物 | ||
| C. | 该反应是置换反应 | D. | 该反应属于离子反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
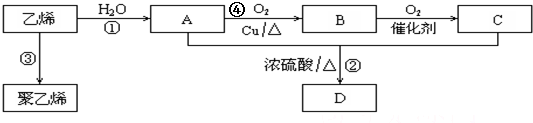
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和浓硫酸加热至140℃反应:2CH3CH2OH$\stackrel{140℃}{→}$CH3CH2OCH2CH3+H2O | |
| B. | 溴乙烷与NaOH醇溶液加热反应:CH3CH2Br+NaOH$→_{△}^{醇}$CH2═CH2↑+NaBr | |
| C. | 苯酚钠溶液中通少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH↓+HCO3- | |
| D. | 乙醛溶液与银氨溶液共热:2CH3CHO+2[Ag(NH3)2]OH$\stackrel{△}{→}$2CH3COONH4+2Ag↓+3NH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化、液化是使煤变成清洁能源,减少环境污染的有效途径 | |
| B. | 高纯硅可制作太阳能电池,二氧化硅可制作光导纤维 | |
| C. | 利用工业生产产生的二氧化碳制造全降解塑料,可以缓解温室效应 | |
| D. | 棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(A)=0.5 mol•L-1•s-1 | B. | υ(D)=1 mol•L-1•s-1 | ||
| C. | υ(C)=1.2 mol•L-1•s-1 | D. | υ(B)=0.5 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用石蕊试纸检验气体需要现用蒸馏水湿润 | |
| B. | 使用容量瓶要先检查是否漏水 | |
| C. | 使用锥形瓶进行酸碱中和滴定要先用待测液润洗 | |
| D. | 使用棕色瓶保存浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,元素Z在周期表中的位置是第三周期ⅣA族.
,元素Z在周期表中的位置是第三周期ⅣA族.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com