

(1)A、B的化学式分别为____________、____________。
(2)写出C+E→、B+Y→反应的化学方程式:_____________、______________。
(3)简要说明A·6H2O受热转变为C和D的原因:___________________________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、X是中学化学中常见的物质,它们之间的转化关系如下图所示(部分产物已略去).请回答下列问题:
A、B、C、X是中学化学中常见的物质,它们之间的转化关系如下图所示(部分产物已略去).请回答下列问题:查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
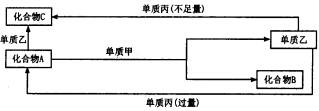
试回答以下问题:
(1)若甲作还原剂,甲是常见金属单质,乙是常见非金属单质,则C的化学式是 ________,A的电子式是________,A与甲反应的化学方程式为________。
(2)若甲作氧化剂,甲是常见的非金属单质,丙是常见金属,且反应都是在溶液中通 常条件下进行,则:①C的化学式是________,②化合物A与单质乙反应的高子方程 式是________。化合物C与单质丙反应的离子方程式是________。化合物A与单质甲 的物质的量之比为2:3时,A与甲恰好完全反应且符合上图所示的转化关系,则反应 的离子方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:043
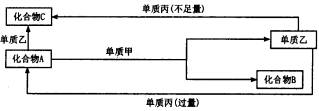
A,B,C是中学化学中常见的无机物,且各由两种元素组成,甲、乙、丙是 三种常见的单质,这些化合物和单质之间存在如下图所示转化关系(这些转化都不需要使用催化剂)。
试回答以下问题:
(1)若甲作还原剂,甲是常见金属单质,乙是常见非金属单质,则C的化学式是 ________,A的电子式是________,A与甲反应的化学方程式为________。
(2)若甲作氧化剂,甲是常见的非金属单质,丙是常见金属,且反应都是在溶液中通 常条件下进行,则:①C的化学式是________,②化合物A与单质乙反应的高子方程 式是________。化合物C与单质丙反应的离子方程式是________。化合物A与单质甲 的物质的量之比为2:3时,A与甲恰好完全反应且符合上图所示的转化关系,则反应 的离子方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B为常见的金属单质,C、D为常见的非金属单质,甲、乙、丙为三种常见的化合物,它们之间的相互转化关系如下图所示(部分产物及反应条件没有列出):

(1)若甲是中学化学中常见的红棕色粉末状固体,则单质A与NaOH溶液反应的离子方程式为 ;B在潮湿的空气中易发生电化学腐蚀,写出其发生电化学腐蚀时原电池负极的电极反应式: 。
(2)若乙在水溶液呈弱酸性,丙是一种大气污染物,有刺激性气味。试写出乙在水溶液中发生电离时的电离方程式 ;已知16g固体单质D完全燃烧转化成乙时,放出148.4kJ的热量,则该反应的热化学方程式为 。
(3)若乙在水溶液呈弱碱性,并可用作农业化肥,D常况下为气体,则进行下列研究: 现将0.40 mol C和0.20 mol D充入10L的密闭容器中,在一定条件下使其发生反应,有关C、D、乙三者的物质的量的变化与时间的关系如右图所示:
①若t1 = 10min,则0至t1时间内C物质的平均反应速率为 ;该反应在t2时达到平衡,其化学反应方程式为 ,此温度下的该反应的平衡常数为 。
②根据图中曲线变化情况判断,t1时刻改变的反应条件可能是 (填下列各项序号)
a.加入了催化剂
b.降低了反应的温度
c.向容器中又充入了气体D

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com