


科目:高中化学 来源: 题型:
| 弱酸 | H2CO3 | H2SO3 | HClO |
| 电离平衡常数 (25℃) |
K1=4.30×10-7 | K1=1.54×10-2 | K=2.95×10-8 |
| K2=5.61×10-11 | K2=1.02×10-7 |
| A、相同温度时三种溶液的pH关系:Na2CO3>NaClO>Na2SO3 |
| B、ClO-+H2O+CO2→HClO+HCO3- |
| C、2ClO-+SO2+H2O→2HClO+SO32- |
| D、等体积、等物质的量浓度的HClO 和Na2CO3混合后溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5颗粒直径约是原子直径的2.5倍 |
| B、淀粉、蔗糖、氨基酸在一定条件都能发生水解反应 |
| C、植物油通常能和氢氧化钠溶液发生反应 |
| D、应该倡议禁止向绿色食品中添加任何化学物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
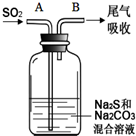 硫、氯及其化合物有广泛的用途.
硫、氯及其化合物有广泛的用途.| 资料:25℃时 | |
| H2CO3 | Ki1=4.4×10-7 |
| H2S | Ki1=1.3×10-7 |
| H2SO3 | Ki1=1.54×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三种元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体.
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三种元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体.查看答案和解析>>
科目:高中化学 来源: 题型:
 通过对模型、图形、图表的观察,能获取有关信息是化学学习的一种重要能力.按要求回答下列问题.
通过对模型、图形、图表的观察,能获取有关信息是化学学习的一种重要能力.按要求回答下列问题.| 元素编号/元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| X | 3.44 | 2.55 | 0.98 | 2.04 | 2.19 | 3.16 | 0.93 | 3.04 | 1.61 | |
| 常见化合价 | 最高价 | +4 | +1 | +3 | +1 | +3 | ||||
| 最低价 | -2 | -4 | -3 | -1 | -3 | |||||
| 物质/20℃时溶解度(g/100g溶剂) | AgNO3 | Ba(NO3)2 | AgCl | BaCl2 |
| 水中 | 216 | 9.02 | 1.9×10-14 | 35.8 |
| 液氨 | 86 | 97.2 | 0.8 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
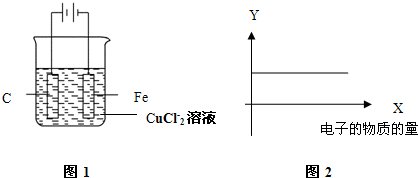
| A、Cu2+物质的量浓度 |
| B、C棒的质量 |
| C、Fe棒的质量 |
| D、Cl-物质的量浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com