
| A. | 电池内部电子从正极流向负极 | |
| B. | 负极电极反应式为:CH4-8e-+10OH-═CO32-+7H2O | |
| C. | 正极电极反应式为:O2+4e-═2O2- | |
| D. | 每消耗22.4 L CH4,外线路中将通过8 mol电子 |
分析 甲烷燃料电池的总反应式与甲烷燃烧的方程式相同,都为CH4+2O2═CO2+2H2O,电池工作时,甲烷在负极被氧化,电极方程式为CH4-8e-+4O2-═CO2+2H2O,氧气在正极被还原,电极反应式为O2+4e-═2O2-,熔融电解质中阳离子向正极移动,阴离子向负极移动.
解答 解:A、电池内部无电子通过,故A错误;
B、甲烷燃料电池的总反应式与甲烷燃烧的方程式相同,都为CH4+2O2═CO2+2H2O,电池工作时,甲烷在负极被氧化,电极方程式为CH4-8e-+4O2-═CO2+2H2O,故B错误;
C、氧气在正极被还原,电极反应式为O2+4e-═2O2-,故C正确;
D、据电极反应式CH4-8e-+4O2-═CO2+2H2O可知,每通过8mol电子消耗1mol甲烷,但不一定是22.4L,故D错误;
故选C.
点评 本题考查化学电源新型电池,题目难度中等,本题注意把握甲烷燃料电池的工作原理,能正确写出电极反应式为解答该题的关键,注意题中电解质.


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源:2016-2017学年黑龙江大庆铁人中学高二上期中化学试卷(解析版) 题型:选择题
向盛有饱和碳酸钠溶液的烧杯中,插入惰性电极,接通直流电源,保持温度不变,一定时间后,
溶液中( )
A.Na2CO3浓度减小
B.Na2CO3浓度增大
C.Na2CO3浓度增大,并有晶体析出
D.Na2CO3浓度不变,并有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\stackrel{+}{C}$H20 | B. | $\stackrel{+}{N}$H3 | C. | $\stackrel{+}{B}$F3 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
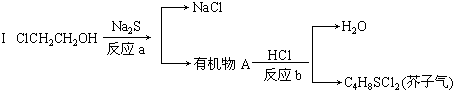

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
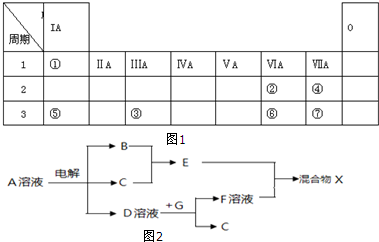
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液:K+、SO32-、CH3COOH、NH3•H2O | |
| B. | 硅酸胶体:H+、K+、SO42-、Br- | |
| C. | 氨水:Na+、Ba2+、Cl-、NO3- | |
| D. | 高锰酸钾溶液:H+、Na+、SO42-、H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al在氧气中燃烧生成A12O3,将Al粉改为Al片 | |
| B. | Fe与稀硫酸反应制取H2时,改用质量分数为98.3%的浓硫酸 | |
| C. | Zn与稀硫酸反应时,适当提高溶液的温度 | |
| D. | Na与水反应时增大水的用量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③ | B. | ②③ | C. | ①② | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com