
| A. | 氟化铵的电子式: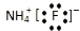 | |
| B. | 原子最外层只有1个电子的元素一定是金属元素 | |
| C. | 离子结构示意图: ,可以表示35Cl-,也可以表示37Cl- ,可以表示35Cl-,也可以表示37Cl- | |
| D. | 1mol CH4与1mol NH4+所含质子数相等 |
分析 A.铵根离子用[],书写错误;
B.原子最外层只有1个电子的元素可能为H;
C. 表示氯离子;
表示氯离子;
C.CH4的质子数为6+4=10,NH4+的质子数为7+4=11.
解答 解:A.氟化铵的电子式为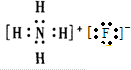 ,故A错误;
,故A错误;
B.原子最外层只有1个电子的元素不一定是金属元素,如H、碱金属元素等,故B错误;
C. 表示氯离子,可以表示35Cl-,也可以表示37Cl-,故C正确;
表示氯离子,可以表示35Cl-,也可以表示37Cl-,故C正确;
D.1mol CH4与1mol NH4+所含质子数分别为10mol、11mol,不相等,故D错误;
故选C.
点评 本题考查化学用语,涉及电子式、结构示意图及原子构成等,为高频考点,把握化学用语的区别及规范使用为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C3H8O | C. | C2H4O2 | D. | CH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S8转化为S6、S4、S2属于物理变化 | |
| B. | 不论哪种硫分子,完全燃烧时都生成SO3 | |
| C. | S8分子中硫原子的杂化方式是sp3杂化 | |
| D. | 把硫单质在空气中加热到750℃即得S2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4$\stackrel{高温}{→}$C+2H2 | B. | 2HI+Cl2=2HCl+I2 | ||
| C. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | D. | C2H6+Cl2$\stackrel{光}{→}$C2H5Cl+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中三个碳原子可能处于同一直线上 | |
| B. | 分子中三个碳原子以单键结合成链状 | |
| C. | C3F8与C3H8互为同分异构体 | |
| D. | 全氟丙烷的电子式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 其含有的共价键类型是极性共价键.
其含有的共价键类型是极性共价键.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
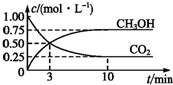 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当金属全部溶解时,无法计算出参与反应的硝酸的物质的量 | |
| B. | 7.2<m<19.2 | |
| C. | 当金属全部溶解时,收集到NO气体的体积一定为4.48L | |
| D. | 当生成沉淀的量达到最大值时,消耗NaOH溶液的体积为120mL |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
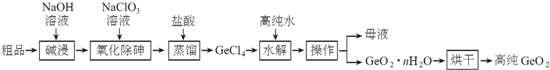
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com