
分析 (1)工业上用一氧化碳还原氧化铁炼铁;
(2)石英玻璃的主要成分为二氧化硅,硅酸盐水泥和陶瓷都需用到的共同的主要原料是黏土;
(3)塑料加工成型后就不会受热熔化,具有热固型;天然橡胶通过硫化措施可增大强度和弹性.
解答 解:(1)一氧化碳还原氧化铁生成铁和二氧化碳,方程式:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
故答案为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(2)石英玻璃的主要成分为二氧化硅,硅酸盐水泥和陶瓷都需用到的共同的主要原料是黏土;
故答案为:二氧化硅;黏土;
(3)塑料加工成型后就不会受热熔化,具有热固型;天然橡胶通过硫化措施使它的分子转化为网状体型结构可增大强度和弹性;
故答案为:热固型;网状体型.
点评 本题为综合题,涉及金属的冶炼、硅酸盐材料的成分、有机高分子材料的性能,题目难度不大,掌握基础是解题关键.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:解答题
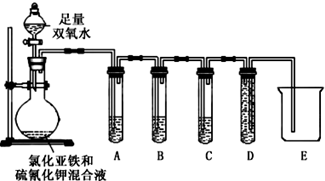
| 实验过程和现象 | 结论 |
| (2)试管A中盛有品红溶液现象:品红溶液褪色 | 证明气体中含有SO2 |
| (3)试管B中现象紫色酸性高锰酸钾溶液颜色不变或变浅试管C中现象:澄清石灰水变浑浊 | 证明气体中含有CO2 |
| 实验过程 | 实验现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③>②>① | B. | ②>①>③ | C. | ①>②>③ | D. | ②>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变温度对反应速率无影响 | |
| B. | 升高温度能加快反应速率 | |
| C. | 使用催化剂能加快反应速率 | |
| D. | 该反应的化学方程式为:2CO+2NO═N2+2CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 牙膏品牌 | 青蛙儿童牙膏 | 佳洁士盐白牙膏 | 中华透明牙膏 |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 盐酸的体积/mL | 50 | 50 | 50 |
| 混合物的质量/g | 9.2 | 15.7 | 27.6 |
| CO2的体积(标准 状况下)/L | 2.24 | 3.36 | 3.36 |
| A. | 盐酸的物质的量浓度为3.0 mol•L-1 | |
| B. | 根据表中数据能计算出混合物中NaHCO3的质量分数为45.65% | |
| C. | 加入混合物9.2 g时盐酸过量 | |
| D. | 15.7 g混合物恰好与盐酸完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨分子的电子式: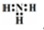 | |
| B. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| C. | O2-的结构示意图为: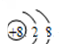 | |
| D. | ${\;}_{35}^{79}$Br的基态原子电子排布式:[Ar]4S24P5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com