
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:
2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:
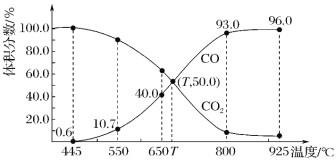
已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是
A.650 ℃时,反应达平衡后 CO2 的转化率为 25.0%
B.550 ℃时,若充入惰性气体,v(正)、v(逆)均减小,平衡不移动
C.T ℃时,若充入等体积的 CO2 和 CO,平衡向正反应方向移动
D.925 ℃时,用平衡分压代替平衡浓度表示的化学平衡常数 Kp=24.0p总
科目:高中化学 来源: 题型:
【题目】某有机物R的结构简式如图,下面有关说法不正确的是( )

A.1molR与足量的Na反应能生成1molH2
B.1molR最多能消耗2molNaOH
C.R能发生取代反应、加成反应、氧化反应、还原反应等反应类型
D.1molR完全燃烧消耗16molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知2A2(g)+B2(g)![]() 2C(g) ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。
2C(g) ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。
(1)a________b(填“>”“=”或“<”)。
(2)若将反应温度升高到700 ℃,该反应的平衡常数将________(填“增大”“减小”或“不变”)。
(3)若在原来的容器中,只加入2 mol C,500 ℃时充分反应达到平衡后, C的浓度________w mol/L(填“>”“=”或“<”)
(4)使该反应的反应速率增大,且平衡向正反应方向移动的操作是________。
a.及时分离出C气体 b.适当升高温度
c.增大B2的浓度 d.选择高效的催化剂
II.氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g)![]() Si3N4(s)+ 6CO(g) △H>0 。
Si3N4(s)+ 6CO(g) △H>0 。
(1)该反应的平衡常数表达式为__________。
(2)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率![]() 与时间t的关系如下图。图中t3时引起平衡移动的条件可以是____________________;t4时引起平衡移动的条件可以是____________________;图中表示平衡混合物中CO的含量最高的一段时间是_________。
与时间t的关系如下图。图中t3时引起平衡移动的条件可以是____________________;t4时引起平衡移动的条件可以是____________________;图中表示平衡混合物中CO的含量最高的一段时间是_________。
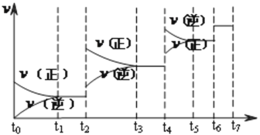
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A.60gSiO2晶体含4NA个σ键
B.78gNa2O2晶体中含有离子个数为4NA
C.在12g石墨中含CC共价键数目为1.5NA
D.CO和N2是等电子体,标况下22.4L的CO气体与1molN2所含的电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )
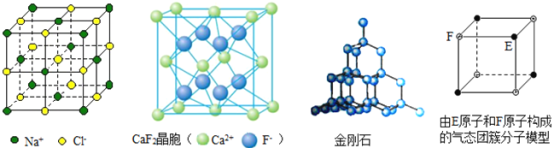
A. 在NaCl晶体中,距Na+最近的Cl-有6个
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,其中所列数字分别代表某一元素。

请你根据表中所给元素,回答下列问题:
(1)表中属于d区的元素是_________(填编号)。
(2)⑤⑥⑦三种元素中电负性最大的是_____(填写元素符号),在第二周期中第一电离能介于②和③之间的元素有_______种;
(3)元素⑨在周期表中的位置_______________。
(4)元素⑧和⑦能形成一种常见的干燥剂,它的电子式为_____________。
(5)写出下列有关反应的离子方程式:⑩的单质与元素③的最高价氧化物,对应的水化物的稀溶液反应:___________________________。
(6)⑥和⑦相比较,非金属性较弱的是______(填元素符号),可以验证你的结论的是下列中的_____(填编号)。
a.气态氢化物的稳定性; b.两元素的电负性;c.含氧酸的酸性; d. 最高化合价
(7)①与③的元素形成的10电子中性分子X的空间构型为_____,它极易溶于水中,请简要说明该物质易溶于水的原因_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种晶体的晶胞结构如图所示,下列有关说法正确的是( )
A.图甲所示晶体的化学式为A3B4C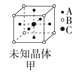
B.图乙所示晶体中阴阳离子个数比为1:1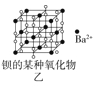
C.图丙所示CaF2晶体中Ca2+配位数为4,F-配位数为8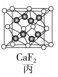
D.图丁所示晶体属于简单立方堆积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钼在工业和国防建设中有重要的作用。钼(Mo)的常见化合价为+6、+5、+4。由钼精矿(主要成分是MoS2)可制备单质钼和钼酸钠晶体(Na2MoO4·2H2O),部分流程如图1所示:
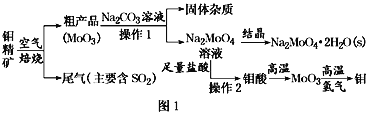
已知:钼酸微溶于水,可溶于液碱和氨水。
回答下列问题:
(1)焙烧钼精矿时发生的化学方程式为_____________________________。
(2)钼精矿焙烧时排放的尾气对环境的主要危害是___________________,请提出一种实验室除去该尾气的方法____________________________________。
(3)操作2的名称为________。由钼酸得到MoO3所用到的硅酸盐材料仪器的名称是________。
(4)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。
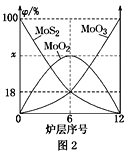
①x=________。
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2的反应,若该反应转移6mol电子,则消耗的氧化剂的化学式及物质的量分别为________、________。
(5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中c(MoO42-)=0.80mol·L1,c(SO42-)=0.04 mol·L1,在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当BaMoO4开始沉淀时,SO42-的去除率是________。[Ksp(BaSO4)=1.1×1010、Ksp(BaMoO4)=4.0×108,溶液体积变化可忽略不计]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com