

| ³ĮµķĪļ | æŖŹ¼³Įµķ | ĶźČ«³Įµķ |
| Al£ØOH£©3 | 3.8 | 5.2 |
| Fe£ØOH£©3 | 2.7 | 3.2 |
| Fe£ØOH£©2 | 7.6 | 9.7 |
| Ni£ØOH£©2 | 7.1 | 9.2 |
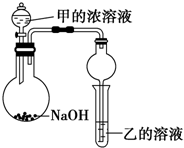
·ÖĪö Į÷³Ģ·ÖĪö£¬Ä³»Æ¹¤³§ÓŠŗ¬Äų“߻ƼĮ·ĻĘ·£ØÖ÷ŅŖ³É·ÖŹĒÄų£¬ŌÓÖŹŹĒĢś”¢ĀĮµ„ÖŹ¼°Ęä»ÆŗĻĪļ£¬ÉŁĮæÄŃČÜŠŌŌÓÖŹ£©£¬¼ī½ž¹żĀĖµĆµ½¹ĢĢå¼ÓČėĖį½ž¹żĀĖ¼ÓČė¹żŃõ»ÆĒāŃõ»ÆŃĒĢśĄė×ÓĪŖĢśĄė×Ó£¬µ÷½ŚČÜŅŗPHŹ¹ĢśĄė×ÓŗĶĀĮĄė×ÓČ«²æ³Įµķ£¬ÄųĄė×Ó²»³Įµķ£¬¹żĀĖŗóµ÷½ŚČÜŅŗPH2-3·ĄÖ¹ÄųĄė×ÓĖ®½ā£¬ĶعżÕō·¢ÅØĖõ£¬ĄäČ“½į¾§£¬¹żĀĖĻ“µÓµĆµ½NiSO4•7H2O¾§Ģ壻
£Ø1£©øł¾Ż·ĻĮĻ³É·ÖÖŖ£¬¼īŗĶĀĮ”¢Ńõ»ÆĀĮ·“Ó¦£¬ČÜŅŗÖŠŗ¬ÓŠĘ«ĀĮĖįøłĄė×Ó£»
£Ø2£©øł¾ŻŹż¾Ż±ķÖŖ£¬Ó¦½«ŃĒĢśĄė×Ó×Ŗ»Æ³ÉĢśĄė×Ó³żČ„£¬¼ÓČėĖ«ŃõĖ®Ńõ»ÆŃĒĢśĄė×ÓÉś³ÉĢśĄė×Ó£¬²»ŅżČėŠĀŌÓÖŹ£®ÓĆĘÆ°×Ņŗ£ØÖ÷ŅŖ³É·Ö“ĪĀČĖįÄĘ£©”¢ĀČĘų”¢ĻõĖįĢę“śĖ«ŃõĖ®»įŅżČėŠĀŌÓÖŹ£®ÓĆŃõĘųĢę“śĖ«ŃõĖ®£»
£Ø3£©¹żĀĖ”¢Õō·¢¶¼ŠčŅŖÓĆ²£Į§ŅĒĘ÷£ŗ²£Į§°ō£¬“ÓĮņĖįÄųČÜŅŗĄļµĆµ½¾§Ģ壬æɲÉČ”ĄäČ“½į¾§µÄ·½·Ø£»
£Ø4£©Čē¹ū¼ÓČėĖ«ŃõĖ®²»×ć£¬»ņ·“Ó¦Ź±¼ä½Ļ¶Ģ£¬ŃĒĢśĄė×Ó²»ÄÜĶźČ«×Ŗ»Æ³ÉĢśĄė×Ó£¬²śĘ·ÖŠ»į»ģÓŠĮņĖįŃĒĢś¾§Ģ壬¼ģŃéFe2+ŹŌ¼ĮæÉŅŌŹĒĀČĖ®£¬KSCNČÜŅŗ”¢ĖįŠŌøßĆĢĖį¼ŲČÜŅŗµČ£»
£Ø5£©µē½ā³ŲÖŠŃō¼«Ź§Č„µē×Ó£¬·¢ÉśŃõ»Æ·“Ó¦£¬ĪŖ³äµē¹ż³Ģ£¬Ōµē³ŲÖŠøŗ¼«Ź§Č„µē×Ó£¬·¢ÉśŃõ»Æ·“Ó¦£®
½ā“š ½ā£ŗĮ÷³Ģ·ÖĪö£¬Ä³»Æ¹¤³§ÓŠŗ¬Äų“߻ƼĮ·ĻĘ·£ØÖ÷ŅŖ³É·ÖŹĒÄų£¬ŌÓÖŹŹĒĢś”¢ĀĮµ„ÖŹ¼°Ęä»ÆŗĻĪļ£¬ÉŁĮæÄŃČÜŠŌŌÓÖŹ£©£¬¼ī½ž¹żĀĖµĆµ½¹ĢĢå¼ÓČėĖį½ž¹żĀĖ¼ÓČė¹żŃõ»ÆĒāŃõ»ÆŃĒĢśĄė×ÓĪŖĢśĄė×Ó£¬µ÷½ŚČÜŅŗPHŹ¹ĢśĄė×ÓŗĶĀĮĄė×ÓČ«²æ³Įµķ£¬ÄųĄė×Ó²»³Įµķ£¬¹żĀĖŗóµ÷½ŚČÜŅŗPH2-3·ĄÖ¹ÄųĄė×ÓĖ®½ā£¬ĶعżÕō·¢ÅØĖõ£¬ĄäČ“½į¾§£¬¹żĀĖĻ“µÓµĆµ½NiSO4•7H2O¾§Ģ壻
£Ø1£©¼īŗĶĀĮ”¢Ńõ»ÆĀĮ¾łÄÜ·“Ó¦£¬ČÜŅŗÖŠŗ¬ÓŠµÄŗ¬ÓŠ½šŹōµÄĄė×ÓŹĒĘ«ĀĮĖįøłĄė×Ó£¬¹Ź“š°øĪŖ£ŗAlO2-£»
£Ø2£©ŃĒĢśĄė×Ó¾ßÓŠ»¹ŌŠŌ£¬Ė«ŃõĖ®¾ßÓŠŃõ»ÆŠŌ£¬¼ÓČėĖ«ŃõĖ®ŹĒĪŖĮĖŃõ»ÆŃĒĢśĄė×Ó³ÉĪŖĢśĄė×Ó£¬Ąė×Ó·“Ó¦·½³ĢŹ½ĪŖ£ŗ2Fe2++H2O2+2H+=2Fe3++2H2O£¬ĘÆ°×Ņŗ£ØÖ÷ŅŖ³É·Ö“ĪĀČĖįÄĘ£©”¢ĀČĘų”¢ĻõĖįĢę“śĖ«ŃõĖ®»įŅżČėŠĀŌÓÖŹ£¬¹Ź“ĖĢę“śŹŌ¼ĮĪŖŃõĘų£¬¹Ź“š°øĪŖ£ŗ2Fe2++H2O2+2H+=2Fe3++2H2O£»A£»
£Ø3£©²Ł×÷aŹĒ¹żĀĖµĆµ½¹ĢĢåŗĶĀĖŅŗ£¬cŹĒÕō·¢ÅØĖõµĆµ½¾§Ģå¹żĀĖµĆµ½NiSO4•7H2O£¬²Ł×÷a”¢cÖŠ¾łŠčŹ¹ÓƵÄŅĒĘ÷ĪŖ²£Į§°ō£¬²Ł×÷CµÄĆū³ĘŹĒÕō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ£¬¹Ź“š°øĪŖ£ŗ²£Į§°ō£»Õō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ£»
£Ø4£©Čē¹ū¼ÓČėĖ«ŃõĖ®²»×ć£¬»ņ·“Ó¦Ź±¼ä½Ļ¶Ģ£¬ŃĒĢśĄė×Ó²»ÄÜĶźČ«±»Ńõ»Æ³ÉĢśĄė×Ó£¬²śĘ·ÖŠ»ģÓŠĀĢ·Æ£»ŃĒĢśĄė×ÓæÉŅŌ±»Ńõ»ÆĪŖĢśĄė×Ó£¬¼ÓČėŃõ»Æ¼Į¼“æÉŃéÖ¤£¬ÕżČ·µÄ·½·ØŹĒ£ŗȔɣĮæѳʷČÜÓŚÕōĮóĖ®£¬µĪ¼ÓĖįŠŌøßĆĢĖį¼ŲČÜŅŗ£¬ČōČÜŅŗ×ĻÉ«ĶŹČ„£¬Ōņ²śĘ·ÖŠŗ¬ÓŠŃĒĢśĄė×Ó£¬
¹Ź“š°øĪŖ£ŗ²śĘ·ÖŠ»ģÓŠĀĢ·Æ£»Č”ÉŁĮæѳʷČÜÓŚÕōĮóĖ®£¬µĪ¼ÓĖįŠŌøßĆĢĖį¼ŲČÜŅŗ£¬ČōČÜŅŗ×ĻÉ«ĶŹČ„£¬Ōņ²śĘ·ÖŠŗ¬ÓŠŃĒĢśĄė×Ó£»
£Ø5£©Ńō¼«Ź§Č„µē×Ó£¬·¢ÉśŃõ»Æ·“Ó¦£¬ŹĒ³äµē¹ż³Ģ£¬¹ŹŃō¼«µē¼«·“Ó¦·½³ĢŹ½ĪŖ£ŗNi£ØOH£©2+OH--e-=NiOOH+H2O£»·ÅµēĪŖŌµē³Ų£¬øŗ¼«Ź§Č„µē×Ó£¬·¢ÉśŃõ»Æ·“Ó¦£¬µē¼«·“Ó¦·½³ĢŹ½ĪŖ£ŗMHx+xOH--xe-=M++xH2O£¬¹Ź“š°øĪŖ£ŗNi£ØOH£©2+OH--e-=NiOOH+H2O£»MHx+xOH--xe-=M++xH2O£®
µćĘĄ ±¾Ģāæ¼²éĪļÖŹµÄÖʱø£¬Éę¼°Ąė×Ó·“Ó¦·½³ĢŹ½ŹéŠ“£¬Ńõ»Æ»¹Ō·“Ó¦£¬Ąė×ÓµÄŃéÖ¤¼°µē»ÆѧŌĄķµČ£¬ĪŖøßæ¼³£¼ūĢāŠĶŗĶøßĘµæ¼µć£¬²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦”¢ŹµŃéÄÜĮ¦µÄ漲飬ĢāÄæÄŃ¶Č²»“ó£®


 µ¼Ń§½Ģ³ĢøßÖŠŠĀæĪ±źĻµĮŠ“š°ø
µ¼Ń§½Ģ³ĢøßÖŠŠĀæĪ±źĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | K+ Na+ NO3- CO32- | B£® | NaŹ® Fe3+ SCN- SO42- | ||
| C£® | K+ NaŹ® Cl- AlO2- | D£® | Al3+ Na+ Cl- SO42- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ĪåÖÖ¶ĢÖÜĘŚŌŖĖŲµÄ²æ·ÖŠŌÖŹŹż¾ŻČēĻĀ£ŗ
ĪåÖÖ¶ĢÖÜĘŚŌŖĖŲµÄ²æ·ÖŠŌÖŹŹż¾ŻČēĻĀ£ŗ| ŌŖĖŲ | T | X | Y | Z | W |
| Ō×Ó°ė¾¶£Ønm£© | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| ×īøß»ņ×īµĶ»ÆŗĻ¼Ū | +1 | +5£¬-3 | +7£¬-1 | +6£¬-2 | +3 |
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
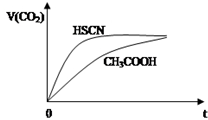 ŅŃÖŖ25”ꏱӊ¹ŲČõĖįµÄµēĄėĘ½ŗā³£Źż£ŗ
ŅŃÖŖ25”ꏱӊ¹ŲČõĖįµÄµēĄėĘ½ŗā³£Źż£ŗ| ČõĖį»ÆѧŹ½ | HSCN | CH3COOH | HCN | H2CO3 |
| µēĄėĘ½ŗā³£Źż | 1.3”Į10-1 | 1.8”Į10-5 | 4.9”Į10-10 | K1=4.3”Į10-7 K2=5.6”Į10-11 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2g | B£® | 4g | C£® | 8g | D£® | 10g |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | O2ŹĒ»¹Ō²śĪļ | |
| B£® | NaOHŹĒŃõ»Æ²śĪļ | |
| C£® | Na2O2ÖŠ£¬-1¼ŪµÄŃõ¼ČµĆµē×Ó£¬ÓÖŹ§µē×Ó | |
| D£® | Na2O2ŹĒŃõ»Æ¼Į£¬Ė®ŹĒ»¹Ō¼Į |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬22.4LHFÖŠŗ¬ÓŠµÄ·Ö×ÓŹżÄæĪŖNA | |
| B£® | .1 L 0.1mol/L µÄFeCl3ČÜŅŗÖŠ£¬Fe3+µÄŹżÄæĪŖ0.1NA | |
| C£® | .±ź×¼×“æöĻĀ£¬2.24LCl2ČÜÓŚĖ®£¬×ŖŅʵĵē×ÓŹżÄæĪŖ0.1NA | |
| D£® | .5.6gFeŌŚ0.1molCl2ÖŠ³ä·ÖČ¼ÉÕ£¬×ŖŅʵĵē×ÓŹżÄæĪŖ0.2NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com