
| A. | 增加稀硫酸用量 | B. | 加几滴硫酸铜溶液 | ||
| C. | 用浓硫酸代替稀硫酸 | D. | 用铁片代替铁粉 |
分析 影响该反应速率因素有:稀硫酸浓度、温度和反应物接触面积等,要使该反应速率加快,可以通过适当增大稀硫酸浓度、升高温度、作原电池等来实现,据此分析解答.
解答 解:A.增加稀硫酸用量,稀硫酸浓度不变,反应速率不变,故A错误;
B.加几滴硫酸铜溶液,Fe和硫酸铜发生置换反应生成Cu,Fe、Cu和稀硫酸构成原电池而加快反应速率,故B正确;
C.浓硫酸和铁发生钝化现象且二者反应生成二氧化硫而不是氢气,故C错误;
D.用铁片代替铁粉,反应物接触面积减小,反应速率减小,故D错误;
故选B.
点评 本题考查化学反应速率影响因素,为高频考点,明确反应速率影响原理是解本题关键,易错选项是C,题目难度不大.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
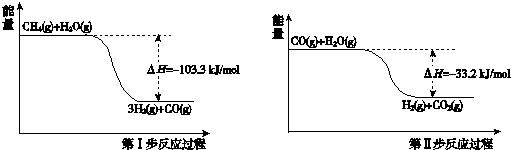
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2O)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO)/mol/L | 0.010 | 0.010 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
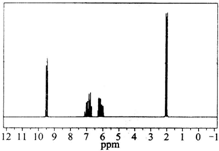 质谱图表明某有机物的相对分子质量为70,红外光谱表征到C═C和C═O的存在,1H核磁共振谱如图(峰面积之比依次为1:1:1:3):
质谱图表明某有机物的相对分子质量为70,红外光谱表征到C═C和C═O的存在,1H核磁共振谱如图(峰面积之比依次为1:1:1:3):查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ③④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 平均风速(m/s) 天气情况 | 空气中SO2的平均含量(mg/L) |
| 雨前 | 0.03 |
| 雨后 | 0.01 |
| 晴 | 0.015 |
| 晴 | 0.03 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com