
���� ��1����֪����CO2��g��+CH4��g��?2CO��g��+2H2��g����H=+247.3kJ•mol-1
��CH4��g��?C��s��+2H2��g����H=+75kJ•mol-1�����ݸ�˹���ܣ�����-�ٵ÷�Ӧ2CO��g��?C��s��+CO2��g����H=-172.3kJ•mol-1����H��0�������ر���ʱ�����жϣ�
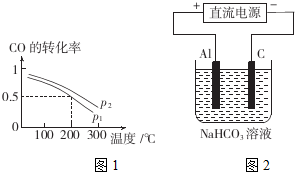
��2���ٸ����¶ȶ�CO��ת���ʵ�Ӱ���жϷ�Ӧ����ЧӦ���÷�ӦΪ���������С�ķ�Ӧ��ѹǿԽ��CO��ת����Խ�ߣ�200��ʱ��CO��ת����Ϊ0.5������ƽ��ʱCO��H2��CH3OH��Ũ�ȷֱ�Ϊ3mol/L����2b-6��mol/L��3mol/L������ƽ�ⳣ���Ķ������ƽ�ⳣ����
����200��ʱ��������Ӧ����tmin�ﵽƽ�⣬����ת������ҺΪ6mol/L������v=$\frac{��v}{��t}$���㣻
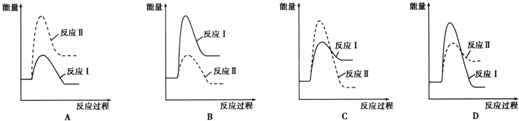
��3���״��Ϳ���Ϊԭ�ϣ����ɼ���ȼ�ϵ�أ������ϼ״�ʧ��������̼������ӣ��ݴ���д�缫��Ӧʽ��
��4������װ��ͼ����������ʧ�������������ӣ������Ӻ�̼��������ӷ���˫ˮ�ⷴӦ��
��5������Ksp[Al�� OH��3]=c��Al3+��•c3��OH-���ɼ�������������ӵ�Ũ�ȣ�����ȷ����Һ��pHֵ��
��� �⣺��1����֪����CO2��g��+CH4��g��?2CO��g��+2H2��g����H=+247.3kJ•mol-1
��CH4��g��?C��s��+2H2��g����H=+75kJ•mol-1�����ݸ�˹���ܣ�����-�ٵ÷�Ӧ2CO��g��?C��s��+CO2��g����H=-172.3kJ•mol-1����H��0�����÷�Ӧ��S��0�����Ը÷�Ӧ���¶Ƚϵ͵������¿����Է����У�
�ʴ�Ϊ���÷�Ӧ�С�H��0����S��0�����¶Ƚϵ͵������¿����Է����У�
��2���ٸ���ͼ��֪���¶�Խ�ߣ�CO��ת����ԽС�����Ը÷�Ӧ������ӦΪ���ȷ�Ӧ������ͼ��ͬ�¶�ʱP2��CO��ת���ʴ���P1�����÷�ӦΪ���������С�ķ�Ӧ��ѹǿԽ��CO��ת����Խ�ߣ�����P1��P2��200��ʱ��CO��ת����Ϊ0.5������ƽ��ʱCO��H2��CH3OH��Ũ�ȷֱ�Ϊ3mol/L����2b-6��mol/L��3mol/L������ƽ�ⳣ��K=$\frac{3mol/L}{3mol/L����2b-6��^{2}mo{l}^{2}/{L}^{2}}$=$\frac{1}{��2b-6��^{2}}$��
�ʴ�Ϊ���ţ�����$\frac{1}{��2b-6��^{2}}$��
����200��ʱ��������Ӧ����tmin�ﵽƽ�⣬����ת����Ũ��Ϊ6mol/L�����Ը�ʱ�����������ƽ����Ӧ����Ϊ$\frac{6mol/L}{tmin}$=$\frac{6}{t}$mol/��L•min����
�ʴ�Ϊ��$\frac{6}{t}$mol/��L•min����
��3���״��Ϳ���Ϊԭ�ϣ����ɼ���ȼ�ϵ�أ������ϼ״�ʧ��������̼������ӣ������ĵ缫��ӦʽΪ��2CH3OH-12e-+16OH-=2CO32-+12H2O��
�ʴ�Ϊ��2CH3OH-12e-+16OH-=2CO32-+12H2O��
��4�����������������ϵ缫��ӦʽΪAl=Al3++3e-�����������ɵ������Ӻ�̼��������ӷ���˫ˮ�ⷴӦ�����������������Ͷ�����̼���壬������Һ�����Al3++3HCO3-=Al��OH��3��+3CO2����
�ʴ�Ϊ��Al=Al3++3e-��Al3++3HCO3-=Al��OH��3��+3CO2����
��5������Ksp[Al�� OH��3]=c��Al3+��•c3��OH-����֪��c��OH-��=$\root{3}{\frac{8.0��10{\;}^{-33}}{1.0��10{\;}^{-6}}}$=2��10-9������c��H+��=5��10-6��pHֵΪ6-lg5=5.3��
�ʴ�Ϊ��5.3��
���� ���⿼���˷�Ӧ���еķ���Ӱ��ƽ���ƶ������ء���Ӧ���ʵļ��㡢ԭ��غ͵���ԭ������Һ��pHֵ�ļ���ȣ���ȷ��ѧƽ���ƶ�ԭ���������缫�Ϸ����ĵ缫��Ӧ�ǽⱾ��ؼ����ѵ��������Ӻ�̼��������ӷ���˫ˮ��ķ�Ӧ����Ŀ�Ѷ��еȣ�


 ״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д� ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�
ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 16g CH4���4NA��C-H�� | |
| B�� | һ�������£����������ڴ��������·�Ӧ����30g NO��ת�Ƶ�����Ϊ5NA�� | |
| C�� | ���³�ѹ�£�13.8g NO2��ˮ��ַ�Ӧ������0.1N A��NO���� | |
| D�� | ��״���£�22.4 LCCl4�к���N A��CCl4���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ag+��Cu2+��Fe2+ | B�� | Cu2+��Ag+��Fe2+ | C�� | Ag+��Fe2+��Cu2+ | D�� | Fe2+��Cu2+��Ag+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
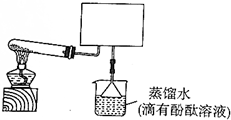 ʵ���ҿ�����ͼ��ʾװ�ã�ȱ���ռ�װ�ã��г̶ֹ�װ������ȥ���Ʊ����ռ�����
ʵ���ҿ�����ͼ��ʾװ�ã�ȱ���ռ�װ�ã��г̶ֹ�װ������ȥ���Ʊ����ռ������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ͨʽΪCnH2n+2����nֵ����̼Ԫ�ص������ٷֺ�����С | |
| B�� | ��ϩ���巢���ӳɷ�Ӧ�IJ���Ϊ������ | |
| C�� | n=7����������5��̼ԭ�ӵ������������� | |
| D�� | 1mol��ǡ����3mol������ȫ�ӳɣ�˵��һ����������������̼̼˫�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com