
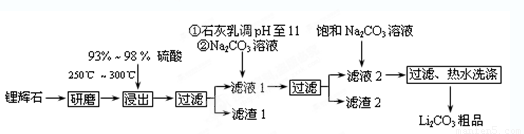
(10分)工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:① Li2O·Al2O3·4SiO2 +H2SO4(浓) Li2SO4+Al2O3·4SiO2·H2O↓
② 某些物质的溶解度(S)如下表所示。
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中反应的离子方程式是 。
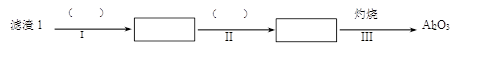
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。
向滤液1中加入石灰乳的作用是(运用化学平衡移动原理解释) 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
① a中,阳极的电极反应式是 。
② b中,生成Li2CO3反应的化学方程式是 。
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源:2013届山西省忻州一中高三第一次月考化学试卷(带解析) 题型:填空题
(12分)工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: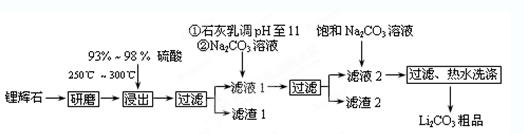
已知:①Li2O·Al2O3·4SiO2 +H2SO4(浓)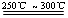 Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓
②某些物质的溶解度(S)如下表所示。
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

查看答案和解析>>
科目:高中化学 来源:2012-2013学年山西省高三第一次月考化学试卷(解析版) 题型:填空题
(12分)工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:① Li2O·Al2O3·4SiO2
+H2SO4(浓) Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓
② 某些物质的溶解度(S)如下表所示。
|
T/℃ |
20 |
40 |
60 |
80 |
|
S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
|
S(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中最佳反应的离子方程式是____________________________。

(2)已知滤液1中的主要离子为Li+、Mg2+、Ca2+、SO42-,滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述,并写离子方程式)
__________________________________________________________________。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
① a中,阳极的电极反应式是______________________________________。
② b中,生成Li2CO3反应的化学方程式是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com