
下列离子方程式正确的是( )
A.向盐酸中滴加氨水:H+ + OH- = H2O
B.Fe(OH)3溶于氢碘酸:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
C.铜溶于稀硝酸:3Cu + 8H+ + 2NO3- = 3Cu2+ + 2 NO ↑+ 4H2O
D.CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-=BaSO4↓
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
有4.8 g CuO、Fe2O3混合物跟足量CO充分反应后固体减少1.28 g,反应后全部气体用0.6 mol·L-1 Ba(OH)2溶液100 mL吸收。下列有关叙述中正确的是 ( )
A.原混合物中CuO与Fe2O3物质的量的比为1∶2
B.原混合物中CuO与Fe2O3的质量比为2∶1
C.吸收CO2后溶液中一定有Ba(HCO3)2
D.反应中生成的CO2体积为1.792 L
查看答案和解析>>
科目:高中化学 来源: 题型:
观察下列各物质间的转化图,仔细分析后回答各题。
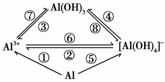
(1)图中属于氧化还原反应的有________个。
(2)若实现图中①②③④各反应的转化,可加入相同的试剂,其名称为________;试写出反应②的离子方程式:____________________________。
若实现图中⑤⑥⑧各转化反应,可加入相同的试剂,其名称为____________;氢氧化铝的用途很多,试写出实验室用反应⑦制取氢氧化铝的离子方程式:________________ ___________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30% H2O2、0.1mol∙L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:_ ___________
___________
 ②设计实验方案:在不同H2O2浓度下,测定 ________________________
②设计实验方案:在不同H2O2浓度下,测定 ________________________ ____________(要求所测得的数据能直接体现反应速率大
____________(要求所测得的数据能直接体现反应速率大 小)。
小)。
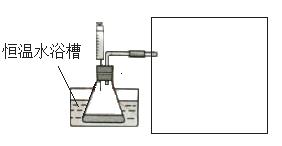
③设计实验装置,完成图20的装置示意图。
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的 数据;数据用字母表示)。
数据;数据用字母表示)。
| 物理量 实验序号 | V[0.1mol·L-1Fe2(SO4)3]/mL | …… | |
| 1 | a | …… | |
| 2 | a | …… |
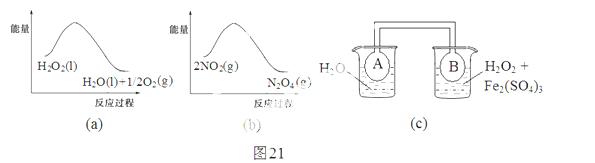
(2)利用图21(a)和21(b)中的信息,按图21(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知两个羟基同时连在同一个碳原子上时结构是不稳定的,它将发生脱水反应,例如:CH3CH(OH)2→CH3CHO +H2O,现有分子式为C9H8O2Br2的物质M,已知E的化学式为C7H5O2Na,A的相对分子质量为46,在一定条件下可发生下列一系列反应:
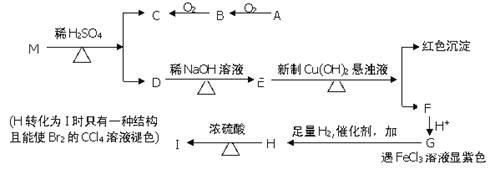
请回答下列问题
(1)B中官能团的名称 ,A的核磁共振氢谱有 个吸收峰;G→H的反应类型 。
(2)M的结构简式
(3)写出下列反应的化学方程式
①A→B ②H→I
(4)同时符合下列条件的G的同分异构体的结构简式有 种,写出其中一种
A.分子中含有苯环 B.能发生水解反应
C.能发生银镜反应 D.与FeCl3溶液反应显紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式中正确的是( )
A. 钠与水反应:2Na+2H2O=2Na++2OH﹣+H2↑
B. 氢氧化钡溶液和硫酸铵溶液反应:Ba2++SO42﹣=BaSO4↓
C. 硫化钠溶于水呈碱性:S2﹣+2H2O⇌H2S+2OH﹣
D. 向溴化亚铁溶液中通入少量氯气:Cl2+2Br﹣=2Cl﹣+Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的锌与100mL 18.5mol•L﹣1浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6L(标准状况).将反应后的溶液稀释至1L,则得溶液中c(H+)=0.1mol•L﹣1,则下列叙述中错误的是( )
|
| A. | 气体A为SO2和H2的混合物 | B. | 气体A中SO2和H2的体积比为1:5 |
|
| C. | 反应中消耗的Zn的质量为97.5 g | D. | 反应中共转移电子3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2、NO是大气污染物。吸收SO2 和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
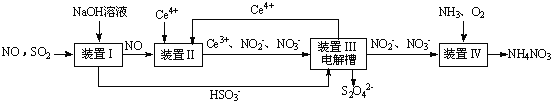
(1)装置Ⅰ中生成HSO3-的离子方程为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如右图所示。
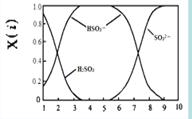
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
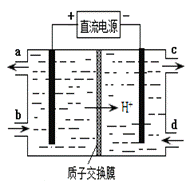
①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com