
���� �����巴Ӧ����X2Y������ΪҺ̬����X2YΪH2O����XΪH��YΪO����X���ʿ���Z������ȼ�գ�������XZ�������Ϊ��ɫ����XZ��������ˮ�������X+��Z-���ӣ�ˮ��Һ��ʹʪ�����ɫʯ����ֽ��죬��XZΪHCl������ZΪCl��������ˮ��Ӧ����HClO������Ư�����ã�ϸ��˿����Z2��g���о���ȼ�գ��Ҳ�������ɫ��Ϊ�Ȼ�����Z���ʺ�����������ȡ��������Һ������������������Һ��Ӧ�����Ȼ��ơ��������ƺ�ˮ��Ȼ�������ʵ����ʼ���ѧ���������
��� �⣺�����巴Ӧ����X2Y������ΪҺ̬����X2YΪH2O����XΪH2��YΪO2����X���ʿ���Z������ȼ�գ�������XZ�������Ϊ��ɫ����XZ��������ˮ�������X+��Z-���ӣ�ˮ��Һ��ʹʪ�����ɫʯ����ֽ��죬��XZΪHCl������ZΪCl2��������ˮ��Ӧ����HClO������Ư�����ã�ϸ��˿����Z2��g���о���ȼ�գ��Ҳ�������ɫ��Ϊ�Ȼ�����Z���ʺ�����������ȡ��������Һ������������������Һ��Ӧ�����Ȼ��ơ��������ƺ�ˮ��
��1��������������֪��XΪH��YΪO��ZΪCl���ʴ�Ϊ����Ԫ�أ���Ԫ�أ���Ԫ�أ�
��2����X���ʿ���Z������ȼ�գ�����XZ������Ϊ��ɫ����Ӧ�Ļ�ѧ����ʽΪ��H2+Cl2$\frac{\underline{\;��ȼ\;}}{\;}$2HCl���ʴ�Ϊ��H2+Cl2$\frac{\underline{\;��ȼ\;}}{\;}$2HCl��
��Z��������X2Y��������Һ����Ư�����ã�������ˮ��Ӧ����HClO��HCl���÷�ӦΪCl2+H2O?HCl+HClO���ʴ�Ϊ��Cl2+H2O?HCl+HClO��
��ϸ��˿����Z2��g���о���ȼ�գ��Ҳ�������ɫ��������������Ӧ�����Ȼ�������Ӧ�Ļ�ѧ����ʽΪ��2Fe+3Cl2$\frac{\underline{\;��ȼ\;}}{\;}$2FeCl3���ʴ�Ϊ��2Fe+3Cl2$\frac{\underline{\;��ȼ\;}}{\;}$2FeCl3��
��Z���ʺ�����������ȡ��������Һ������������������Һ��Ӧ�����Ȼ��ơ��������ƺ�ˮ����Ӧ�Ļ�ѧ����ʽ��Cl2+2NaOH=NaCl+NaClO+H2O��
�ʴ�Ϊ��Cl2+2NaOH=NaCl+NaClO+H2O��
��3��ͭ˿��Z2��g���о���ȼ�������ػ�ɫ�̣���Ӧ�Ļ�ѧ����ʽΪ��Cu+Cl2$\frac{\underline{\;\;��\;\;}}{\;}$CuCl2������ƿ�м�ˮ����ҺΪ��ɫ���ʴ�Ϊ���ػ�ɫ������
����������Ķ�����̼��ˮ���������������������̼��Ӧ����̼���ƺ���������ˮ��Ӧ�����������ƺ���������ѧ����ʽ��2Na2O2+2CO2�T2Na2CO3+O2 2Na2O2+2H2O=4NaOH+O2������Ҫ�Ǻ����Ķ�����̼�������Ʒ�Ӧ�ṩ������
�ʴ�Ϊ��2Na2O2+2CO2�T2Na2CO3+O2��2Na2O2+2H2O=4NaOH+O2����
���� ���⿼��������ƶϣ���ȷ������ˮΪҺ�弰HClO����Ư���ԡ�������������ȼ�����ɽ��ע��������ʵ����ʼ���Ӧ������Ŀ�Ѷ��еȣ�


 ����ѵ����ֱͨ�п�����ϵ�д�
����ѵ����ֱͨ�п�����ϵ�д� һ���㶨ϵ�д�
һ���㶨ϵ�д� ��У��ҵ��ϵ�д�
��У��ҵ��ϵ�д� ���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
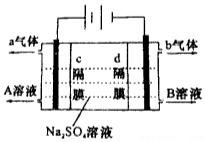 ˫��Ĥ���صĽṹʾ���ͼ��ͼ��ʾ�����ø�װ�ÿ��Ե����������Һ����ȡ������������ƣ����õ��������������Ը�װ�ü���ԭ���ж���ȷ���ǣ�������
˫��Ĥ���صĽṹʾ���ͼ��ͼ��ʾ�����ø�װ�ÿ��Ե����������Һ����ȡ������������ƣ����õ��������������Ը�װ�ü���ԭ���ж���ȷ���ǣ�������| A�� | a����Ϊ������b����Ϊ���� | |
| B�� | A��ҺΪNaOH��BΪH2SO4 | |
| C�� | c��ĤΪ�����ӽ���Ĥ��d��ĤΪ�����ӽ���Ĥ | |
| D�� | �õ�ⷴӦ���ܷ���ʽ���Ա�ʾΪ��2Na2SO4+6H2O$\frac{\underline{\;ͨ��\;}}{\;}$2H2SO4+4NaOH+O2��+2H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ʽ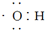 ���Ա�ʾ�ǻ���Ҳ���Ա�ʾ���������� ���Ա�ʾ�ǻ���Ҳ���Ա�ʾ���������� | |
| B�� | ����ģ��  ���Ա�ʾ������̼���ӣ�Ҳ���Ա�ʾˮ���� ���Ա�ʾ������̼���ӣ�Ҳ���Ա�ʾˮ���� | |
| C�� | ������ˮ������Al��OH��3���壬����������ˮɱ�� | |
| D�� | ԭ�ӽṹʾ��ͼ 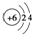 ���Ա�ʾ12C��Ҳ���Ա�ʾ14C ���Ա�ʾ12C��Ҳ���Ա�ʾ14C |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ȼ�����Һ�е�����������Һ | B�� | ������ԭ����ͭ | ||
| C�� | ��Ƭ��������ͭ��Һ�� | D�� | ������ˮ�������¼��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 21���ͣ���ѧ���������ƶ����Ͽ�ѧ�ķ�չ��ʹ���������ܲ��ϵ�������Ϊ���� | |
| B�� | ��ѧ�ҿ������۲����ϲ��ݷ��Ӻ�ԭ�ӣ���װ���Ӳ��ϡ����������ͷ��ӻ��� | |
| C�� | ������Ԫ�صķ��ֺ��ִ����ӻ�ѧ���۵Ľ��������ǽ���20���ͺ��ִ���ѧ���ش�ɾ� | |
| D�� | ������ѧ�����������ԭ��ѧ˵��Ϊ������ѧ�ķ�չ�춨�˼�ʵ�Ļ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
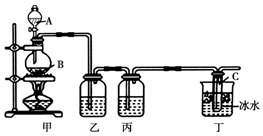 ij��ѧ�С��������ͼ��ʾװ�ý���ʵ����ȡƯ��Һ���������ƺ��Ȼ��ƵĻ����Һ��������ߴ������ƺ�����ͼ��ƿ��ʢ����ʳ��ˮ��ƿ��ʢŨ���ᣬ��Һ©��A��ʢŨ���ᣮ����������ʾ��Cl2��NaOH�ڲ�ͬ�¶��£����ﲻͬ���ڽϸ��¶���������NaClO3���Իش�
ij��ѧ�С��������ͼ��ʾװ�ý���ʵ����ȡƯ��Һ���������ƺ��Ȼ��ƵĻ����Һ��������ߴ������ƺ�����ͼ��ƿ��ʢ����ʳ��ˮ��ƿ��ʢŨ���ᣬ��Һ©��A��ʢŨ���ᣮ����������ʾ��Cl2��NaOH�ڲ�ͬ�¶��£����ﲻͬ���ڽϸ��¶���������NaClO3���Իش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��1 L 1 mol/L��NaCl��Һ��ȡ��10 mL����Ũ������1 mol/L | |
| B�� | 10 mL��������Ϊ98%��H2SO4����ˮϡ����100 mL��H2SO4����������Ϊ9.8% | |
| C�� | 0.5 L 2 mol/L BaCl2��Һ�У�Ba2+��Cl-����ԼΪ3��6.02��1023 | |
| D�� | ����0.5 L 10 mol/L�����ᣬ��Ҫ��״���µ��Ȼ�������112 L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com