
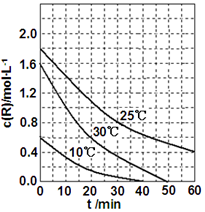
 为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图.下列说法不正确的是( )
为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图.下列说法不正确的是( )| A. | 25℃时,在10~30min内,R 的分解平均速率为0.030 mol•L-1•min-1 | |
| B. | 对比30℃和10℃曲线,在50min时,R的分解百分率相等 | |
| C. | 对比30℃和25℃曲线,在0~50min内,能说明R的分解平均速率随温度升高而增大 | |
| D. | 对比30℃和10℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大 |
分析 A.结合v=$\frac{△c}{△t}$计算;
B.对比30℃和10℃曲线,在50min时,R均完全分解;
C.对比30℃和25℃曲线,在50min时,温度高时R完全分解;
D.对比30℃和10℃曲线,40min时温度低的完全分解.
解答 解:A.25℃时,在10~30min内,R 的分解平均速率为$\frac{1.4mol/L-0.8mol/L}{20min}$=0.030 mol•L-1•min-1,故A正确;
B.对比30℃和10℃曲线,在50min时,R均完全分解,则R的分解百分率相等,故B正确;
C.对比30℃和25℃曲线,在50min时,温度高时R完全分解,则说明R的分解平均速率随温度升高而增大,故C正确;
D.对比30℃和10℃曲线,40min时温度低的完全分解,则说明R的分解速率随温度降到而增大,故D错误;
故选D.
点评 本题考查影响反应速率的因素,为高频考点,把握图中温度与分解速率的关系为解答本题关键,侧重分析与应用能力的考查,注意判断不同温度和时间时分解率,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
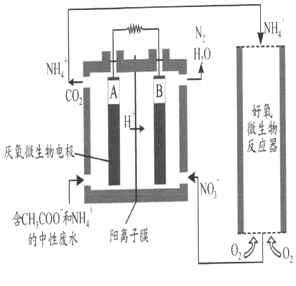
 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:| 滴定次数 | 滴定起始读数(mL) | 滴定终点读数(mL) |
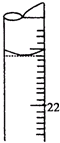
| 第一次 | 1.08 | 见右图 |
| 第二次 | 2.02 | 24.52 |
| 第三次 | 1.00 | 20.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
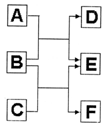 A、B、C、D、E、F六种中学常见的物质,皆有短周期元素组成,有转化关系:
A、B、C、D、E、F六种中学常见的物质,皆有短周期元素组成,有转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向浸取液中加入BaCl2有白色沉淀,不能说明其中含有SO42- | |
| B. | 向浸取液中加入AgNO3溶液有白色沉淀,说明其中含有Cl- | |
| C. | 洁净铂丝蘸取浸取液少许,在酒精灯火焰上灼烧,火焰呈黄色,不能确定是否含K+ | |
| D. | 向浸取液中滴加稀硫酸,产生无色无味的气体,说明其中含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?H3O++CO32- | B. | HS-+H2O?H2S+OH- | ||
| C. | Fe3++3H2O?Fe(OH)3↓+3H+ | D. | Br-+H2O?HBr+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
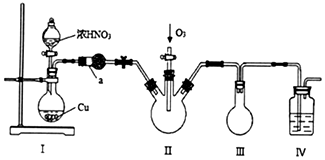
| 物质 | 熔点/℃ | 沸点/℃ |
| N2O5 | 41 | 32 (升华) |
| N2O4 | -11 | 24 |
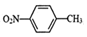 ,相对分子质量137).步骤如下:在三口烧瓶中放入催化剂和30mL N2O5的CH2Cl2溶液(N2O5的浓度为lmol•L-1),30℃时,滴加15mL甲苯,充分反应得对硝基甲苯 1.73g.回答下列问题:
,相对分子质量137).步骤如下:在三口烧瓶中放入催化剂和30mL N2O5的CH2Cl2溶液(N2O5的浓度为lmol•L-1),30℃时,滴加15mL甲苯,充分反应得对硝基甲苯 1.73g.回答下列问题: +N2O5$→_{△}^{催化剂}$
+N2O5$→_{△}^{催化剂}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
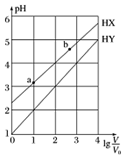 浓度均为0.1mol•L-1、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg$\frac{v}{{v}_{0}}$的变化关系如图所示.下列叙述正确的是( )
浓度均为0.1mol•L-1、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg$\frac{v}{{v}_{0}}$的变化关系如图所示.下列叙述正确的是( )| A. | 常温下,由水电离出的c(H+)•c(OH -):a<b | |
| B. | HX、HY都是弱酸,且HX的酸性比HY的弱 | |
| C. | 相同温度下,电离常数K( HX):a>b | |
| D. | lg$\frac{v}{{v}_{0}}$=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则$\frac{c({X}^{-})}{c({Y}^{-})}$减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com