
【题目】如图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物.(反应条件图中已省略) 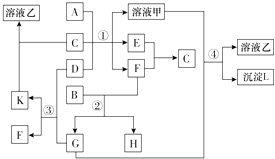
(1)A,B,C,D代表的物质分别为、、、(填化学式).
(2)反应①中的C、D均过量,该反应的化学方程式是 .
(3)反应④的离子方程式为 .
【答案】
(1)Al;C;H2O;Na2O2
(2)4Al+6H2O+2Na2O2=4NaAlO2+O2↑+6H2↑
(3)2AlO2﹣+CO2+3H2O=2Al(OH)3↓+CO32﹣
【解析】解:转化关系中各物质均由短周期元素组成,A为常见的金属单质,则A为Al,B为非金属单质,一般是黑色粉末,则B为碳,C是常见的无色无味液体,C为H2O,D是淡黄色的固体化合物,则D为Na2O2 , 由反应①可知甲为NaAlO2 , E、F分别为O2和H2中的一种,B能与F反应生成G与H,且G能与过氧化钠反应生成F与K,可推知F为O2 , E为H2 , G为CO2 , H为CO,K为Na2CO3 , 由反应④可知L为Al(OH)3 , 溶液乙为Na2CO3溶液,(1)由上述分析,可知A为Al,B为C,C为H2O,D为Na2O2 ,
所以答案是:Al;C;H2O;Na2O2;(2)反应①中的C、D均过量,生成的氢氧化钠溶液能和Al完全反应,该反应的化学方程式是:2H2O+2Na2O2=4NaOH+O2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,总反应方程式为:4Al+6H2O+2Na2O2=4NaAlO2+O2↑+6H2↑,
所以答案是:4Al+6H2O+2Na2O2=4NaAlO2+O2↑+6H2↑;(3)反应④的离子方程式为:2AlO2﹣+CO2+3H2O=2Al(OH)3↓+CO32﹣ ,
所以答案是:2AlO2﹣+CO2+3H2O=2Al(OH)3↓+CO32﹣ .


科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3 , 只含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
回答下列问题:
(1)实验室进行过滤用到的玻璃仪器有烧杯、玻璃棒、 .
(2)上述反应是否都是氧化还原反应(填“是”或“否”);写出反应①的化学方程式 .
(3)反应①后过滤的沉淀为 , 简述确定此物质中金属元素及其价态的操作过程 .
(4)利用铝制得的镁铝合金用途很广泛,比如用作手机机身,某课外活动小组欲对某一品牌手机机身的铝镁合金进行研究,测定其中铝的质量分数.过量盐酸
I.他们利用盐酸、氢氧化钠溶液设计下列实验方案:
方案:铝镁合金 ![]() 溶液
溶液 ![]()
![]() 称量灼烧产物的质量.用该方案进行实验时,除了称量灼烧产物的质量外,还需称量的是 .
称量灼烧产物的质量.用该方案进行实验时,除了称量灼烧产物的质量外,还需称量的是 .
II.拓展研究:在向铝镁合金溶于盐酸后的溶液中加入过量NaOH溶液时,生成沉淀的质量与加入NaOH溶液体积的关系可用数轴关系表示:
当加入60~70ml氢氧化钠溶液时,请写出发生的离子方程式 . 你判断,根据图数轴中的数据能否求出合金中铝的质量分数?(选填“能”或“不能”).
下列①②两题选一题作答.(多答不给分)
①若不能求出合金中铝的质量分数,请说明理由.
②若能求出合金中铝的质量分数,则铝的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备纳米颗粒Y的反应是3Fe2++2S2O32﹣+O2+XOH﹣═Y+S4O62﹣+2H2O,下列说法中,正确的是( )
A.Y的化学式为Fe2O3
B.x=6
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为 ![]() mol
mol
D.每生成1mol Y,反应转移的电子总数为4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠是日常生活的必需品,也是重要的化工原料.粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质.以下是粗盐提纯的操作流程.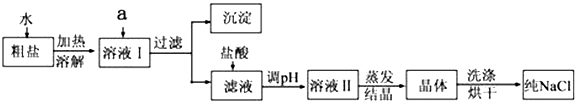
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液、稀盐酸.
(1)欲除去溶液I中的MgCl2、CaCl2、Na2SO4 , 从提供的试剂中选出a所代表的试剂,试剂的选择和滴加顺序均正确的是:;
A.Na2CO3溶液、BaCl2溶液、NaOH溶液
B.溶液、NaOH溶液、K2CO3溶液
C.NaOH溶液、BaCl2溶液、Na2CO3溶液
D.Ba(NO3)2、NaOH溶液、Na2CO3溶液
E.BaCl2溶液、Na2CO3溶液、NaOH溶液
(2)过量碳酸盐溶液的作用是 .
(3)洗涤晶体操作使用的玻璃仪器有 .
(4)蒸发结晶的操作方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下四种微粒14N、15N、N2、N4(结构为  ),已知断裂1mol N﹣N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
),已知断裂1mol N﹣N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
A.14N2与15N2互为同位素,N4与N2互为同素异形体
B.N4属于一种新型的化合物
C.14N与15N化学性质不相同
D.1mol N4气体完全转变为N2将放出882kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)=0.100molL﹣1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( ) 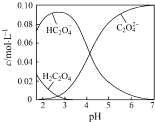
A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42﹣)>c(HC2O4﹣)
B.c(Na+)=0.100 molL﹣1的溶液中:c(H+)+c(H2C2O4)=c(OH﹣)+c(C2O42﹣)
C.c(HC2O4﹣)=c(C2O42﹣)的溶液中:c(Na+)>0.100 molL﹣1+c(HC2O4﹣)
D.pH=7的溶液中:c(Na+)>2c(C2O42﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所使用的装置(夹持装置略)、试剂和操作方法都正确的是( )
A.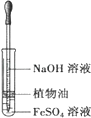 观察Fe(OH)2的生成
观察Fe(OH)2的生成
B.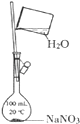 配制一定物质的量浓度的NaNO3溶液
配制一定物质的量浓度的NaNO3溶液
C.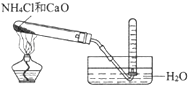 实验室制取氨
实验室制取氨
D.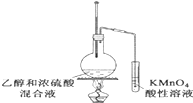 验证乙烯的生成
验证乙烯的生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.化学反应中的能量变化都表现为热量变化
B.需要加热才能发生的反应不一定是吸热反应
C.向醋酸钠溶液中滴入酚酞试液,加热后若溶液红色加深,则说明盐类水解是吸热的
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学--选修2:化学与技术]双氧水是一种重要的氧化剂、漂白剂和消毒剂.生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水.回答下列问题:
(1)蒽醌法制备H2O2理论上消耗的原料是 , 循环使用的原料是 , 配制工作液时采用有机溶剂而不采用水的原因是 .
(2)氢化物A中反应的化学方程式为 . 进入氧化塔C的反应混合液中的主要溶质为 .
(3)萃取塔D中的萃取剂是 , 选择其作萃取剂的原因是 .
(4)工作液再生装置F中要除净残留的H2O2 , 原因是 .
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为 , 一种双氧水的质量分数为27.5%(密度为1.10gcm﹣3),其浓度为molL﹣1 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com