
| A. | 1:1 | B. | 5:4 | C. | 4:3 | D. | 5:3 |
分析 如果按4P+3O2=2P2O3(容器1),O2过量,n(P2O3)=$\frac{1}{2}$n(P)$\frac{1}{2}$ mol;如果按4P+5O2=P2O5(容器2),P过量,n(P2O5)=$\frac{2}{5}$n(O2)=$\frac{2}{5}$mol,然后求两者的物质的量之比.
解答 解:按4P+3O2=2P2O3(容器1),O2过量,n(P2O3)=$\frac{1}{2}$n(P)$\frac{1}{2}$ mol;按4P+5O2=P2O5(容器2),P过量,n(P2O5)=$\frac{2}{5}$n(O2)=$\frac{2}{5}$mol,所以充分反应后得到P2O3和P2O5的物质的量之比是$\frac{1}{2}$:$\frac{2}{5}$=5:4,故选B.
点评 本题考查有磷与氧气按不同量之比得到和产物物不同的过量问题的判断,学生只要能按照两种反应的原理进行过量计算,就可以解答了.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K=1.77×10-4 | K=4.9×10-10 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | 在NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-) | |
| B. | 向NaCN溶液中通入少量CO2的离子方程式:2CN-+H2O+CO2=2HCN+CO32- | |
| C. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者 | |
| D. | 等物质的量浓度的各溶液pH关系为:pH(NaHCO3)>pH(NaCN)>pH(HCOONa) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L Na2SO3溶液中c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) | |
| B. | 0.1 mol•L-1 NaHCO3溶液中;c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 对滴有酚酞的CH3COONa溶液进行加热,溶液颜色会加深 | |
| D. | 在pH=5.6的CH3COOH与CH3COONa的混合溶液中:c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6 L 氟化氢中含有氟原子的数目为1.5NA | |
| B. | pH均为5的NH4Cl和NaHSO4溶液中水电离出的氢离子数目均为10-5NA | |
| C. | 在1L 0.1 mol•L-1CuSO4溶液中,阴离子总数大于0.1 NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molIH2,在一定条件下充分反应,转移电子的数目为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E | G | |
| 最低化合价 | -4 | -2 | -1 | -2 | -1 | -3 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 | 3.0 |
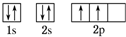 C原子的价电子排布式3s23p5
C原子的价电子排布式3s23p5查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化银的浊液中加入氯化钠溶液,氯化银的溶解度减小 | |
| B. | 向2.0×10-1mol/L的K2CrO4溶液中加入等体积的2.0×10-1mol/LAgNO3溶液,则有Ag2CrO4沉淀生成 | |
| C. | 将一定量的AgCl和Ag2CrO4固体棍合物溶于蒸馏水中,充分溶解后,静置,上层清液中Cl-的物质的量浓度最大 | |
| D. | 将0.001 mol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001 mol/L的K2CrO4溶液,则先产生AgCl沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=3.6mol/(L•s) | B. | v(B)=0.075mol/(L•s) | C. | v(C)=0.030mol/(L•s) | D. | v(D)=0.060mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
| 开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
| 完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
| A. | 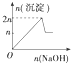 | B. | 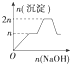 | C. |  | D. | 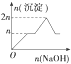 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com