
【题目】目前,我国使用的能源主要是煤、石油、天然气等,这些能源都是不可再生且污染环境的能源,研究和开发清洁而又用之不竭的能源是未来发展的首要任务。科学家预测氢能将是21世纪最理想的新能源之一。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气。下列可供开发又较经济且资源可持续利用的制氢气的方法是________(填序号)。
A.电解水 B.锌和稀硫酸反应 C.光解海水
(2)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:![]()
![]()
![]()
![]()
由甲烷制氢气的一个缺点是________。
(3)将![]() 进行热分解也可以制得氢气
进行热分解也可以制得氢气![]()
![]() 。热分解制氢气时,常向反应器中通入一定比例的空气,使部分
。热分解制氢气时,常向反应器中通入一定比例的空气,使部分![]() 燃烧,其目的是_________________________。
燃烧,其目的是_________________________。
(4)镁铝合金(![]() )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的
)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的![]() 、
、![]() 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为
单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为![]() 得到的混合物
得到的混合物![]() 在一定条件下可释放出氢气。
在一定条件下可释放出氢气。
①熔炼制备镁铝合金(![]() )时通入氩气的目的是____________________________________。
)时通入氩气的目的是____________________________________。
②在足量的![]() 的
的![]() 溶液中,混合物Y能完全释放出
溶液中,混合物Y能完全释放出![]() 。
。![]()
![]() 完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出
完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出![]() 的物质的量为________。
的物质的量为________。
【答案】C 需要消耗大量能量(其他合理答案也可) 为H2S的热分解反应提供热量 防止Mg、Al被空气氧化 52mol
【解析】
1molMg17Al12可得到17molMgH2和12molAl,加入足量HCl,一方面Mg和Al与HCl反应放出氢气,另一方面,Mg和Al溶解,储存的氢气释放出来。
(1) A.电解水消耗大量的电能,不经济,A错误;
B.锌和稀硫酸反应消耗大量的Zn和硫酸,不经济,B错误;
C.太阳能和海水取之不尽,经济且可持续,C正确;
故答案为:C;
(2)两个反应都是吸热反应,需要消耗大量的能量,故答案为:需要消耗大量能量(其他合理答案也可);
(3)H2S分解产生H2的反应是吸热反应,部分H2S燃烧可产生热量,提供给H2S分解,故答案为:为H2S的热分解反应提供热量;
(4)①氩气是稀有气体,化学性质不活泼,可以防止Mg、Al在熔化过程中被氧气氧化,故答案为:防止Mg、Al被空气氧化;
②1molMg17Al12可得到17molMgH2和12molAl,加入足量HCl,一方面Mg和Al与HCl反应放出氢气,另一方面,Mg和Al溶解,储存的氢气释放出来。由Mg~H2可知,1molMg产生1molH2,17molMg产生17molH2,17molMgH2产生17mol+17mol=34molH2,由2Al~3H2可知,1molAl可产生1.5molH2,所以12molAl可产生12mol×1.5=18molH2,故1molMg17Al12完全吸氢后的Y与HCl反应共放出34mol+18mol=52molH2,故答案为:52mol。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】化合物Y具有抗菌、消炎作用,可由X制得。
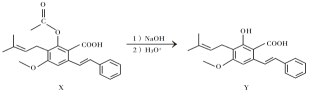
下列有关化合物X、Y的说法不正确的是
A.![]() 最多能与
最多能与![]() 反应
反应
B.Y与乙醇发生酯化反应可得到X
C.X、Y均能与酸性![]() 溶液反应,且均存在顺反异构体
溶液反应,且均存在顺反异构体
D.室温下X、Y分别与足量![]() 加成的产物分子中手性碳原子数目相等
加成的产物分子中手性碳原子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,发生反应2NO2(g)![]() N2O4(g)。下列所给量不再变化表明该反应已达平衡状态的是( )
N2O4(g)。下列所给量不再变化表明该反应已达平衡状态的是( )
A.混合气体的压强B.混合气体的质量
C.混合气体的密度D.混合气体各组分的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的合金及其化合物在现代生产、生活中有着广泛的应用。如二氧化锰是重要的氧化剂、催化剂、干电池中的去极剂;硫酸锰是重要的微量元素肥料。
Ⅰ.某工厂以菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料联合生产二氧化锰、硫酸锰晶体的工艺流程如下图所示:
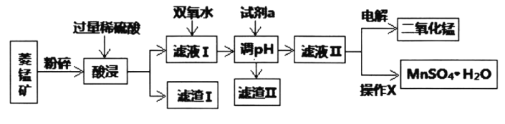
常温下几种金属氧化物沉淀时的pH:
Mn(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时的pH | 7.2 | 2.7 | 4.7 |
完全沉淀时的pH | x | 3.7 | 6.7 |
(1)该工厂调pH时,选择试剂a的成分最好是________,滤渣Ⅱ的成分是________,操作X是________、洗涤、低温烘干。
(2)为确保除尽杂质而又不损失锰,pH调整的范围为________;若常温下离子(X)沉淀完全的标准是c(X)<1.0×10-5mol/L,Ksp[Mn(OH)2]=1.0×10-13,则使Mn2+完全沉淀时溶液的pH最小为________。
(3)若滤液Ⅱ显酸性,请写出电解法制备MnO2时阳极上的电极反应式:________。
Ⅱ.50.7g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化曲线)如下图所示。(已知:M(Mn)=55g/mol)

(1)850℃时,所得固体的化学式为:________________________。
(2)1150℃时,反应的化学方程式为:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的正反应为________热反应,且m+n________p(填“>”、“=”或“<”)。
以下各题填“增大”、“减小”或“不变”
(2)若加入催化剂,平衡时气体混合物的总物质的量________。
(3)若体积不变加入B,则A的转化率________,B的转化率________。
(4)减压时,A的质量分数________;增压时,B的质量分数________。
(5)若升高温度,则B的浓度________,平衡时B、C的浓度之比![]() 将________。
将________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)达到新平衡时混合物颜色________;若压强不变,则加入C达到新平衡时混合物颜色________。(填“变深”、“变浅”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④B.②③C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多
B.由C(石墨)=C(金刚石)ΔH=+11.9kJ/mol,可知金刚石比石墨稳定
C.我国目前使用的主要能源是化石燃料,属于不可再生能源
D.可表示氢气燃烧热的热化学方程式为H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ/mol
O2(g)=H2O(g) ΔH=-241.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种广泛用于锂离子电池的物质结构如图所示。X、Y、Z、W为原子序数依次递增的四种短周期主族元素,Y、W同主族,原子半径r(X)>r(Y)>r(Z)。下列说法正确的是
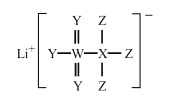
A.X的氢化物中只有极性键
B.Y在该物质中有两种不同价态
C.Z的单质能与水反应生成Y的单质
D.简单离子的还原性W<Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com