
| A. | 增加体系的压强 | B. | 减少C的物质的量浓度 | ||
| C. | 增加A的物质的量 | D. | 升高体系的温度 |
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Cl-离子的结构示意图: | B. | 白磷分子的比例模型: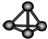 | ||
| C. | H2O2的结构式:H-O-O-H | D. | CCl4的电子式: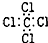 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上和净化后的水煤气在催化剂作用下,与水蒸气发生反应制取氢气,化学方程式为:CO(g)+H2O(g)?H2(g)+CO2(g).一定条件下,将4molCO与2molH2O(g)充入体积为2L的密闭容器中,体系中各物质的深度随时间变化如图所示:
工业上和净化后的水煤气在催化剂作用下,与水蒸气发生反应制取氢气,化学方程式为:CO(g)+H2O(g)?H2(g)+CO2(g).一定条件下,将4molCO与2molH2O(g)充入体积为2L的密闭容器中,体系中各物质的深度随时间变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl晶体中阴、阳离子 | B. | NH3分子中的质子和电子 | ||
| C. | Na2O2固体中阴、阳离子 | D. | ${\;}_{1}^{2}$H原子中的质子和中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 元素周期表是元素周期律的具体表现形式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-戊烯的同分异构体数目为五种 | |
| B. | 丙烯与HCl加成产物是1-氯丙烷 | |
| C. | 组成为CnH2n的烃,当n=4时,才具有同分异构体 | |
| D. | 能使溴水或酸性KMnO4溶液褪色的C4H8的物质可能有三种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li在空气中的燃烧产物为Li2O2 | B. | Be(OH)2 溶于NaOH可生成BeO2- | ||
| C. | BeO是两性氧化物 | D. | B2O3既能溶于强酸又能溶于强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)某同学做如下实验,以检验反应中的能量变化.
(1)某同学做如下实验,以检验反应中的能量变化.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com