
| A. | v(H2)=0.03 mol/(L•min) | B. | v(N2)=0.02 mol/(L•min) | ||
| C. | v(NH3)=0.17 mol/(L•min) | D. | v(NH3)=0.01 mol/(L•min) |
分析 先根据氨气增加的物质的量和物质的量浓度公式计算其物质的量浓度,反应速率v=$\frac{△c}{△t}$计算得到氨气表示的反应速率,根据同一反应中各物质的反应速率之比等于其计量数之比计算氢气、氮气的速率.
解答 解:在一定条件下,反应N2+3H2?2NH3,在2L密闭容器中进行,5min内氨的质量增加了0.1mol,氨气表示的反应速率v(NH3)=$\frac{\frac{0.1mol}{2L}}{5min}$=0.01mol/(L•min)
A.v(H2)=$\frac{3}{2}$v(NH3)=$\frac{3}{2}$×0.01mol/(L•min)=0.015mol/(L•min),故A错误;
B.v(N2)=$\frac{1}{2}$v(NH3)=0.005 mol/(L•min),故B错误;
C.v(NH3)=0.01mol/(L•min),故C错误;
D.v(NH3)=0.01mol/(L•min),故D正确;
故选D.
点评 本题考查的是反应速率的定量表示方法,根据同一反应中各物质的反应速率之比等于其计量数之比是解本题的关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | Li、Be、B原子最外层电子数依次升高 | |
| B. | P、S、Cl元素最高正化合价依次升高 | |
| C. | B、C、N、O、F原 子半径依次升高 | |
| D. | Li、Na、K的原子半径依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

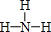 .②的简单气态氢化物的电子式为
.②的简单气态氢化物的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 符号为${\;}_8^{18}O$的原子常用于文物年代的测定 | |
| B. | CO2分子比例模型: | |
| C. | H2O2的电子式: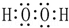 | |
| D. | 结构简式为CH2CH2的分子可发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
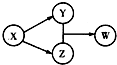 X、Y、Z、W四种物质的转化关系如图所示(部分反应物与产物已略),下列组合中不符合该关系的是( )
X、Y、Z、W四种物质的转化关系如图所示(部分反应物与产物已略),下列组合中不符合该关系的是( )| A | B | C | D | |
| X | HCl | Na2O2 | Na2CO3 | Al |
| Y | FeCl2 | NaOH | CO2 | Na[Al(OH)4] |
| Z | Cl2 | Na2CO3 | CaCO3 | AlCl3 |
| W | FeCl3 | NaHCO3 | Ca(HCO3)2 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 X、Y、Z、W四种短周期元素在周期表中的位置关系如图:若Z元素原子的最外层电子数是电子层数的2倍.
X、Y、Z、W四种短周期元素在周期表中的位置关系如图:若Z元素原子的最外层电子数是电子层数的2倍. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应放出197 kJ 的热量 | |
| B. | 生成SO3为2 mol | |
| C. | SO2和SO3物质的量之和为2 mol | |
| D. | SO2的物质的量和SO3物质的量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com