
| 4.97 |
| 54+17n+35.5(6-n) |
| 14.35 |
| 143.5 |


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
| A、在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 |
| B、利用太阳能、潮汐能、风力发电,以获取清洁能源 |
| C、大量排放SO2或CO2都会导致酸雨的形成 |
| D、采用纳米二氧化钛光触媒技术,将汽车尾气中的NO和CO转化为无害气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图所示装置进行实验,实验现象正确的是( )
用如图所示装置进行实验,实验现象正确的是( )| X | Y | Z | 实验现象 | |
| A | 苯酚浑浊液 | NaOH溶液 | 盐酸 | 浑浊液变澄清,后又变浑浊 |
| B | FeCl3溶液 | KSCN溶液 | 饱和KCl溶液 | 溶液变为红色,后颜色加深 |
| C | KI溶液 | 足量氯水 | 乙醇 | 溶液变为黄色,后溶液分层,上层为紫红色,下层为无色 |
| D | Na2SO3溶液 | Ba(NO3)2溶液 | 盐酸 | 生成白色沉淀,后沉淀溶解,有大量气体生成 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
| B、将“地沟油”制成肥皂,可以提高资源的利用率 |
| C、我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 |
| D、减少烟花爆竹的燃放,有利于降低空气中的PM2.5含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
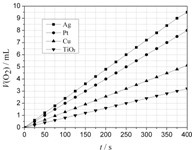 某些金属及金属氧化物对H2O2的分解反应具有催化作用,请回答下列问题:
某些金属及金属氧化物对H2O2的分解反应具有催化作用,请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |

| 阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
| 浓度/mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯酚--有机物 纯碱--盐 水--氧化物 |
| B、淀粉--混合物 胆矾--纯净物 漂白粉--化合物 |
| C、液氯--非电解质 碳酸钙--强电解质 醋酸--弱电解质 |
| D、金刚石--原子晶体 食盐--离子晶体 二氧化硅--分子晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com