
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 1 mol Na2O2固体中含离子总数为4NA | |
| C. | 1mol羟基与17 g NH3所含电子数之比为9:10 | |
| D. | 1mol Na2CO3晶体中含 CO${\;}_{3}^{2-}$离子数小于1 NA |
分析 A、电解精炼铜时,阳极上除了铜放电,还有比铜活泼的金属放电;
B、过氧化钠中含2个钠离子和1个过氧根;
C、羟基中含9个电子,而氨气为10电子微粒;
D、碳酸钠中含2个钠离子和1个碳酸根.
解答 解:A、电解精炼铜时,阳极上除了铜放电,还有比铜活泼的金属放电,故当转移NA个电子时,阳极的质量减少小于32g,故A错误;
B、过氧化钠中含2个钠离子和1个过氧根,故1mol过氧化钠中含2mol钠离子和1mol过氧根即3NA个,故B错误;
C、羟基中含9个电子,而氨气为10电子微粒,故1mol羟基中含9mol电子,而17g氨气即1mol氨气中含10mol电子,故个数为9:10,故C正确;
D、碳酸钠中含2个钠离子和1个碳酸根,故1mol碳酸钠中含碳酸根的个数为NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 得电子越多的氧化剂,其氧化性就越强 | |
| C. | 阳离子只有氧化性,阴离子只有还原性 | |
| D. | 有单质参加的反应不一定属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 | NaClO |
| pH | 11.6 | 9.7 | 12.3 | 10.0 | 4.0 | 10.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | LiH和D2O反应,所得氢气的摩尔质量为4 g•mol-1 | |
| B. | 1 mol LiAlH4在125℃完全分解转移3 mol电子 | |
| C. | LiH与水反应的化学方程式为LiH+H2O═LiOH+H2↑ | |
| D. | LiH中微粒半径r(Li+)<r(H-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ③④ | C. | ②④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
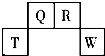 短周期元素 T、Q、R、W 在元素周期表中的位置如图所示,其中 T 所处的周期序数与主族 族序数相等.它们的最高价氧化物水化物依次为甲、乙、丙、丁.下列叙述不正确的是( )
短周期元素 T、Q、R、W 在元素周期表中的位置如图所示,其中 T 所处的周期序数与主族 族序数相等.它们的最高价氧化物水化物依次为甲、乙、丙、丁.下列叙述不正确的是( )| A. | 甲、乙、丙、丁受热均易分解 | |
| B. | 常温下丁的浓溶液可用 T 单质所制的容器来盛装 | |
| C. | 丁的浓溶液与 Q 的单质加热发生反应,可生成体积比为 1:2 的两种气体 | |
| D. | R 的氧化物在空气中与其它物质作用可形成光化学烟雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序r(X)>r(Y)>r(Z)>r(R)>r(W) | |
| B. | 氢气在R的单质中燃烧火焰呈蓝色 | |
| C. | 元素X的氢化物的稳定性比Y的弱 | |
| D. | Y与Z形成的两种化合物中的化学键类型均相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com