
【题目】某兴趣小组设计了如下实验测定海带中碘元素的含量,依次经过以下四个步骤,下列图示装置和原理能达到实验目的的是
A.灼烧海带
B.将海带灰溶解后分离出不溶性杂质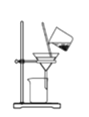
C.制备Cl2,并将I-氧化为I2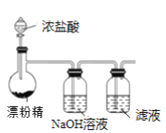
D.以淀粉为指示剂,用Na2SO3标准溶液滴定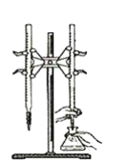
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】SBP电解法能大幅度提高电解槽的生产能力,如图为SBP电解法制备MoO3的示意图,下列说法错误的是( )
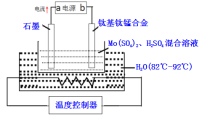
A.a极为电源的负极,发生氧化反应
B.电路中转移4mol电子,则石墨电极上产生标准状况下22.4LO2
C.钛基钛锰合金电极发生的电极反应为:3H2O+Mo4+-2e-=MoO3+6H+
D.电路中电子流向为:a极![]() 石墨,钛基钛锰电极
石墨,钛基钛锰电极![]() b极
b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通过氮气和氢气反应合成氨,氨经一系列反应可以得到硝酸。反应历程如下图所示,下列说法不正确的是( )
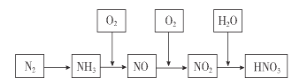
A. 氨可用作制冷剂
B. 铵态氮肥一般不能与碱性化肥共同使用
C. 硝酸可用于制化肥、农药、炸药、染料、盐类等
D. 某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1mol![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一个原子形成的离子可表示为![]() n-,下列说法正确的是( )
n-,下列说法正确的是( )
A.![]() n-中含有的中子数为a+b
n-中含有的中子数为a+b
B.![]() n-中含有的电子数为a-n
n-中含有的电子数为a-n
C.X原子的质量数为a+b+n
D.一个X原子的质量约为![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】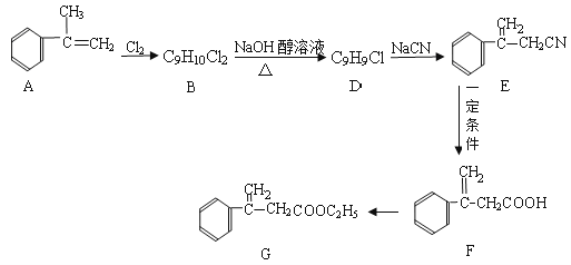
(1)F的官能团名称____________;
(2)B→D的化学反应方程式为______;
(3)D→E的化学反应类型为___________;
(4)F转化为G的化学反应方程式为_______;
(5)H是F的同分异构体,它是苯的邻位二取代物,遇FeCl3溶液显示特征颜色,则H可能的结构简式为(任写一种)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是在实验室进行氨的快速制备与性质探究实验的组合装置,部分固定装置未画出。

(1)在组装好装置后,若要检验A~E装置的气密性,其操作是首先________________,打开弹簧夹1,在E中装入水,然后微热A,观察到E中有气泡冒出,移开酒精灯,E中导管内有水柱形成,说明装置气密性良好。
(2)装置B中盛放的试剂是________。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗活塞,稍等片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生_______(答现象);从E中逸出液面的气体可以直接排入空气中,请写出在C中发生反应的化学方程式:_________________________________________。
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量,若反应前固体质量为16g,反应后固体质量减少2.4g,通过计算确定该固体产物的成分:________(用化学式表示)。
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中,写出产生白烟的化学方程式:______________________,迅速产生倒吸的原因是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
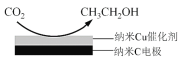
【题目】十九大报告提出要对环境问题进行全面、系统的可持续治理。绿色能源是实施可持续发展的重要途径,利用生物乙醇来制取绿色能源氢气的部分反应过程如下图所示:
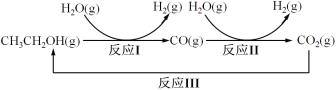
(1)已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H1= - 41 kJ/mol
CO2(g)+H2(g) △H1= - 41 kJ/mol
CH3CH2OH(g)+3H2O(g)![]() 2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
请写出反应I的热化学方程式_____________________________。
(2)反应II,在进气比[n(CO) : n(H2O)]不同时,测得相应的CO平衡转化率见下图
(各点对应的反应温度可能相同,也可能不同;各点对应的其他反应条件都相同)。

① 经分析,A、E和G三点对应的反应温度相同,其原因是KA=KE=KG=________(填数值)。在该温度下:要提高CO平衡转化率,除了改变进气比之外,还可采取的措施是________。
② 对比分析B、E、F三点,可得出对应的进气比和反应温度的变化趋势之间的关系是_____________________________________________________________。
③ 比较A、B两点对应的反应速率大小:VA______VB(填“<” “=”或“>”)。反应速率v=v正-v逆=![]() -
-![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时![]() =__________ (计算结果保留1位小数)。
=__________ (计算结果保留1位小数)。
(3)反应III,利用碳酸钾溶液吸收CO2得到饱和的KHCO3电解液,电解活化的CO2来制备乙醇。
①已知碳酸的电离常数Ka1=10-a,Ka2=10-b,吸收足量CO2所得饱和KHCO3溶液的pH=c,则该溶液中lg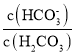 =____________________________________(列出计算式)。
=____________________________________(列出计算式)。
②在饱和KHCO3电解液中电解CO2来制备乙醇的原理如图所示。则阴极的电极反应式是_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
a | 原子核外电子分别占3个不同能级,且每个能级上排布的电子数相同 |
b | 基态原子的p轨道电子数比s轨道电子数少1 |
c | 在周期表所列元素中电负性最大 |
d | 位于周期表中第4纵行 |
e | 基态原子M层全充满,N层只有一个电子 |
请回答:
(1)d属于________区的元素,其基态原子的价电子排布图为_________。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为________(用元素符号表示)。
(3)c的氢化物水溶液中存在的氢键有________种,任意画出一种________。
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为________(用化学式表示)。若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为________;A的中心原子的轨道杂化类型为________;与A互为等电子体的一种分子为________(填化学式)。
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为________,若该晶体的相对分子质量为M,密度为ag/cm![]() ,则晶胞的体积为________(NA用表示阿伏加德罗常数的值)。
,则晶胞的体积为________(NA用表示阿伏加德罗常数的值)。
(6)a形成的某种单质的层状结构如图,其中a原子数、a—a键数、六元环数之比为____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛矿的酸性废液(含TiO2+、Fe2+、Fe3+、SO42-等),可回收获得FeS2纳米材料、Fe2O3和TiO2·nH2O等产品,流程如下:
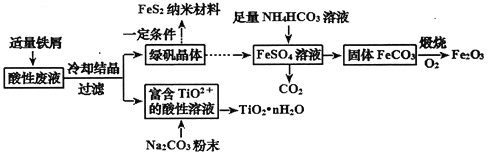
(1)TiO2+中钛元素的化合价为________价。TiO2+只能存在于强酸性溶液中,因为TiO2+易水解生成TiO2·nH2O,写出水解的离子方程式_________________________________。
(2)向富含TiO2+的酸性溶液中加入Na2CO3粉末能得到固体TiO2·nH2O。请用化学反应原理解释__________________________________。
(3)NH4HCO3溶液与FeSO4溶液反应的离子方程式为_______________________,该反应需控制温度在308K以下,其目的是_____________________________。
(4)已知298K时,Ksp[Fe(OH)2]=8.0×10-16,若在生成的FeCO3达到沉淀溶解平衡时,测得溶液的pH为8.5,c(Fe2+)=1.0×10-5mol·L-1,则所得的FeCO3中________Fe(OH)2(填“有”或“没有”)。
(5)FeS2纳米材料可用于制造高容量锂电池,已知电解质为熔融的K2S,电池放电时的总反应为:4Li+FeS2=Fe+2Li2S,则正极的电极反应式是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com