
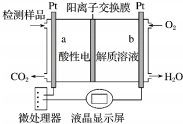
| A. | 溶液中H+从b向a定向移动 | |
| B. | a电极发生的电极反应为CH3OH-6e-+H2O=CO2↑+6H+ | |
| C. | 当电路中有1 mol e-转移时,正极区n(H+)增加1 mol | |
| D. | 将酸性电解质溶液改为碱性电解质溶液,该测试仪不可能产生电流 |
分析 A.原电池工作时,电解质溶液中阳离子向正极移动;
B.燃料在原电池的负极上发生失电子的氧化反应;
C.氧气在原电池的正极上发生得电子的还原反应,氢离子在正极参加反应;
D.根据原电池的构成条件以及能量的转化来回答.
解答 解:A.装置为燃料电池,燃料通入负极,氧气通入正极,则a为负极,b为正极,电解质溶液中阳离子(氢离子)向正极(b)移动,故A错误;
B.a电极是负极,发生的电极反应为:CH3OH+H2O-6e-═CO2↑+6H+,故B正确;
C.正极的电极反应是:O2+4H++4e-═H2O,当电路中有1 mol e-转移时,正极区n(H+)减少1 mol,故C错误;
D.将酸性电解质溶液改为碱性电解质溶液该测试仪一样是原电池,同样可以产生电流,故D错误;
故选B.
点评 本题考查学生原电池的工作原理知识,明确正负极的判断和电极反应的书写是解题的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1s22s12p1 | B. | 1s22s22p63s23p64s1 | ||
| C. | 1s22s22p33s1 | D. | 1s22s22p63s13p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水库的钢闸门与电源负极相连以防止其生锈,该法即牺牲阳极的阴极保护法 | |
| B. | 明矾和漂白粉用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| C. | 铜的精炼工业和电镀铜工业,均可采用CuSO4溶液做电解质溶液 | |
| D. | 工业上合成氨采用500℃左右的温度,其原因是适当加快NH3的合成速率,催化剂在500℃左右时其活性最好,且能提高H2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打-Na2CO3 | B. | 钡餐-BaCO3 | ||
| C. | 漂白粉的有效成分-Ca(ClO)2 | D. | 水玻璃-H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 钠有多种化合物,如氧化钠、过氧化钠、氢氧化钠、碳酸钠、碳酸氢钠,这些物质在实际生活中有广泛的应用,在一定条件下相互间能进行转化.
钠有多种化合物,如氧化钠、过氧化钠、氢氧化钠、碳酸钠、碳酸氢钠,这些物质在实际生活中有广泛的应用,在一定条件下相互间能进行转化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳与水反应吸收131.3 kJ的热量 | |
| B. | 1 mol碳和1 mol水反应吸收131.3 kJ的热量 | |
| C. | 1 mol固态碳与1 mol水蒸气反应产生一氧化碳气体和氢气,吸收131.3 kJ的热量 | |
| D. | 固态碳和气态水各1 mol反应,放出131.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被氧化的物质是氧化剂 | |
| B. | 失去电子,化合价降低的物质是还原剂 | |
| C. | 还原剂被还原,氧化剂被氧化 | |
| D. | 得到电子,化合价降低的反应物是氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com